
山东理工大家C[H, Y2-] = c · Si, = 0.02 ×0.95 = 0.02mol/L推论: Na,H,Y·2H,O→Na+ +H,Y溶液pH=4.4(4)H,Y:EDTA溶解度小0.02g/100mlH,O22℃CEDTA=7 X 10-4mol/LNa,H,Y溶解度大11.1g/100mlH,022℃CEDTA=0.3mol/L配成0.01~~0.02mol/L的水溶液pH=4.411
11 推论: Na2H2Y·2H2O → Na+ +H2Y 溶液pH=4.4 [H Y ] H Y 0.02 0.95 0.02mol/L 2 2 2 = = = − c (4)H4Y: EDTA溶解度小0.02g/100mlH2O 22℃ cEDTA=7×10-4mol/L Na2H2Y溶解度大 11.1g/100mlH2O 22℃ cEDTA=0.3mol/L 配成0.01~~0.02mol/L的水溶液 pH=4.4
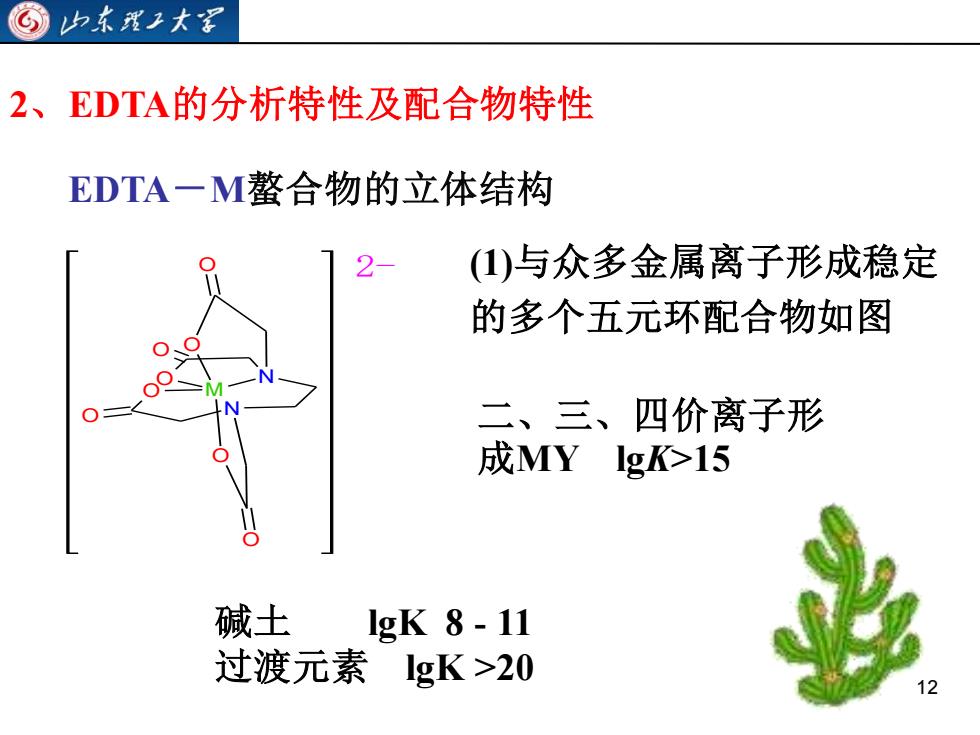
山东理工大家2、EDTA的分析特性及配合物特性EDTA一M鳌合物的立体结构(1)与众多金属离子形成稳定2的多个五元环配合物如图二、三、四价离子形成MYIgK>15碱土IgK 8 - 11过渡元素IgK >2012
12 2、EDTA的分析特性及配合物特性 EDTA-M螯合物的立体结构 N M N O O O O O O O O 2- (1)与众多金属离子形成稳定 的多个五元环配合物如图 二、三、四价离子形 成MY lgK>15 碱土 lgK 8 - 11 过渡元素 lgK >20

山东理工大客(2)配合比固定而简单,多数为1:1型,少数为2:1型(如Mo(V)计量数关系为1:1,通式略电荷:M+Y-MY(3)配合物带电荷且易溶于水(4)反应快,滴定终点易判断(5)离子带色,形成MY也带色且颜色加深,可定性分析CuYNiYCoYMnY蓝绿(深蓝)(玫瑰)(紫红)CrYCr(OH)Y2-FeYFe(OH)Y2-(黄)(褐)(蓝)(深紫)13
13 (2) 配合比固定而简单,多数为1:1型,少数为2:1型 (如: Mo(Ⅴ)) 计量数关系为1:1,通式略电荷: M+Y=MY (3) 配合物带电荷且易溶于水 (4)反应快,滴定终点易判断 (5)离子带色,形成MY也带色且颜色加深,可定性分析 CuY NiY CoY MnY (深蓝) (蓝绿) (玫瑰) (紫红) CrY Cr(OH)Y2- FeY Fe(OH)Y2- (深紫) (蓝) (黄) (褐)

山东理工大家3.2:配位平衡配合物的形成常数(稳定常数)(Stability orformation constant)1、1:1型络合物M+YMY[MY]KMY=[MI[Y]=K形=K稳稳定常数的大小反应了络合物的稳定性14
14 3.2: 配位平衡 一、配合物的形成常数(稳定常数) (Stability or formation constant) =K形 =K稳 [MY] [M][Y] KMY= 稳定常数的大小反应了络合物的稳定性 M+Y MY 1、1:1型络合物

山东理工大家1、1:n型络合物常数(形成)(1)、逐级稳定[ML]M+LMLK1[MI[L]ML+LML[ML2]K2[MLI|L]...天[ML,]MLn-1 +L←MLK.[MLn-i][L]15
15 [ML] [M][L] K1= 1、1:n型络合物 (1)、逐级稳定(形成)常数 M+LML ML+L ML2 MLn-1 +L MLn [ML2 ] [ML][L] K2= [MLn ] [MLn-1 ][L] Kn = ● ● ● ● ● ●