
运城学院应用化学系 有机化学实验课件 (蒸馏、分馏及沸点的测定) 主讲人:弓巧娟 有机化
运城学院应用化学系 有机化学实验课件 (蒸馏、分馏及沸点的测定) 主讲人: 弓巧娟

菱馏、分馏及佛点的测定 一、实验目的: 1、了解蒸馏和测定沸点的意义; 2、理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏, 什么情况下用分馏。 3、熟练掌握蒸馏装置的安装和使用方法 4、掌握分馏柱的工作原理和常压下的简单分馏操作方法
蒸馏、分馏及沸点的测定 一、实验目的: 1、了解蒸馏和测定沸点的意义; 2、理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏, 什么情况下用分馏。 3、熟练掌握蒸馏装置的安装和使用方法 4、掌握分馏柱的工作原理和常压下的简单分馏操作方法
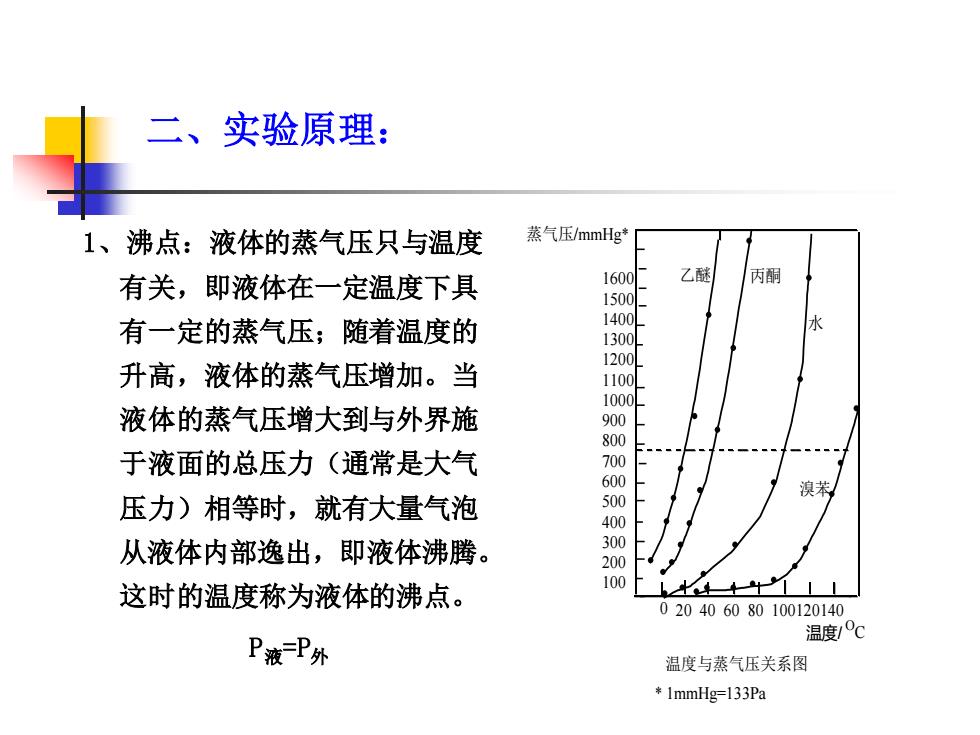
二、实验原理: 1、沸点:液体的蒸气压只与温度 蒸气压/mmHg* 有关,即液体在一定温度下具 1600 乙醚 丙酮 1500 有一定的蒸气压;随着温度的 1400 1300 1200 升高,液体的蒸气压增加。当 1100 1000 液体的蒸气压增大到与外界施 900 800 于液面的总压力(通常是大气 700 600 溴苯 压力)相等时,就有大量气泡 500 400 从液体内部逸出,即液体沸腾。 300 200 这时的温度称为液体的沸点。 100 020406080100120140 温度/c P液P外 温度与蒸气压关系图 1mmHg=133Pa
二、实验原理: 1、沸点:液体的蒸气压只与温度 有关,即液体在一定温度下具 有一定的蒸气压;随着温度的 升高,液体的蒸气压增加。当 液体的蒸气压增大到与外界施 于液面的总压力(通常是大气 压力)相等时,就有大量气泡 从液体内部逸出,即液体沸腾。 这时的温度称为液体的沸点。 P液=P外 0 20 40 60 80 100120140 1600 1500 1400 1300 1200 1100 1000 900 800 700 600 500 400 300 200 100 温度/ 蒸气压/mmHg* O C 温度与蒸气压关系图 * 1mmHg=133Pa 乙醚 丙酮 水 溴苯

通常所说的沸点是在0.1Mpa(即760 nmHg)压力下液体的沸腾温 度。例如水的沸点为100℃,即指大气压为760 nmHg时,水在 100℃时沸腾。在其它压力下的沸点应注明,如水的沸点可表 示为95℃/85.3kPa. 注意: 纯粹的液体有机化合物在一定的压力下具有一定的沸点。可初 步鉴定物质。但是具有固定沸点的液体不一定都是纯粹的化合 物,因为某些有机化合物常和其它组分形成二元或三元共沸混 合物,它们也有一定的沸点
通常所说的沸点是在0.1Mpa(即760mmHg)压力下液体的沸腾温 度。例如水的沸点为100oC,即指大气压为760mmHg时,水在 100oC时沸腾。在其它压力下的沸点应注明,如水的沸点可表 示为95oC/85.3kPa。 注意: 纯粹的液体有机化合物在一定的压力下具有一定的沸点。可初 步鉴定物质。但是具有固定沸点的液体不一定都是纯粹的化合 物,因为某些有机化合物常和其它组分形成二元或三元共沸混 合物,它们也有一定的沸点

2、蒸馏 蒸馏就是将液体化合物加热至沸腾变为蒸气,又将蒸气冷凝为液体 化合物这两个过程的联合操作过程。它是分离液体有机化合物最常 用的一种方法。 3、蒸馏的作用: 1)通过蒸馏可将易挥发的物质和不挥发的物质分开。 2)将沸点不同的液体化合物分开,但不同液体沸点必须相差30℃ 以上。 3)可测化合物的沸点
2、蒸馏 蒸馏就是将液体化合物加热至沸腾变为蒸气,又将蒸气冷凝为液体 化合物这两个过程的联合操作过程。它是分离液体有机化合物最常 用的一种方法。 3、蒸馏的作用: 1)通过蒸馏可将易挥发的物质和不挥发的物质分开。 2)将沸点不同的液体化合物分开,但不同液体沸点必须相差30℃ 以上。 3)可测化合物的沸点