
自来水中余氯量的测定 水中余氯的来源主要是饮用水或污水中加氯以杀灭或抑制微生物:电镜废水中加氯以分解 有毒的氰化物。氯以单质或次氯酸盐的形式加入水中后,经水解生成游离性有效氯,包括分 子氯、次氯酸和次氯酸盐离子等形式。其间的相对比例决定于水的H值和水温的高低,在多 数水体的 值下, 主要是以次氯酸和次氯酸盐离子形式存在 采用氯化法对饮用水消毒时,应明确下列三个概念,即余氯、加氯量及需氯量。饮用水用 氯或氯素化合物消毒,经过一定时间接触后,水中所余留的氯称为“余氯”。 余氯可为下列三种:(1)总余氯-包括NH,C1、HOC1、C10及NHC1,:(2)化合性余氯 =-包括N阻C1、NC1,及其他的氯胺类化合物:(3)游离性氯-一-包括HOC1、C10等。 我国生活饮用水卫生标准中规定集中式给水出厂的游离氯含量不低于0.3mg/儿,管网末梢 水不低于0.05mg/L 加入水中的氯量称为加氯量,将加氯量减去余氯量即是水样的需氯量。 、自来水中余氯的测定 方法原理 采用碘量滴定法。余氯在酸姓介质中与碘化钾作用,生成定量的碘,再以硫代疏酸钠标准 溶液滴定。本法测定值为总余氯,包括M,C1、HOC、CI0及NHC1 反应方程式为 C10+21+2H =1,+C1+H0 1,+25,0°+4组+=21+5,0*+2H,0 1.仪器 破式滴定管(50m1) 碘量瓶(或250m1具塞三角瓶) 2.测试步骤 自来水中不含高铁及亚硝酸盐,故可直接测定。在250ml碘量瓶中(或三角瓶中)放置 0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后 再取水样)置于碘量瓶或具寒三角瓶中,迅速塞上寒摇动,见水样早漆黄色,加1m1淀粉溶 液变蓝,则说明水样中有余氯,以标准硫代硫酸钠溶液滴定,至溶液蓝色消失呈无色透明溶 液,记下硫代硫酸钠溶液的体积 3.计算 总余氯(C1,mg.L)=V:×M×70.91×1000/V V,-疏代疏酸钠标准溶液的体积(m1) M一-硫代硫酸钠标准溶液浓度(mol.L) V-一自来水水样的体积(1) 4.试剂 (1)分析纯的碘化钾(要求不含游离碘及碘酸钾) (2)近似0.01或0.005mol.L1硫代硫酸钠溶液,当水中余氯量低于1mg.L时用0.005moL.L 的稀溶液滴定。 (3)0.5%淀粉溶液 (④)1:4的硫 (⑤)醋酸盐缓冲溶液(州=4),水样中有高铁及亚硝酸盐及锰时,可用该缓冲溶液进行酸化
自来水中余氯量的测定 水中余氯的来源主要是饮用水或污水中加氯以杀灭或抑制微生物;电镀废水中加氯以分解 有毒的氰化物。氯以单质或次氯酸盐的形式加入水中后,经水解生成游离性有效氯,包括分 子氯、次氯酸和次氯酸盐离子等形式。其间的相对比例决定于水的 pH 值和水温的高低,在多 数水体的 pH 值下,主要是以次氯酸和次氯酸盐离子形式存在。 采用氯化法对饮用水消毒时,应明确下列三个概念,即余氯、加氯量及需氯量。饮用水用 氯或氯素化合物消毒,经过一定时间接触后,水中所余留的氯称为“余氯”。 余氯可为下列三种:(1)总余氯-包括 NH2Cl、HOCl、ClO -及 NHCl2;(2)化合性余氯 -包括 NH2Cl、NHCl2 及其他的氯胺类化合物;(3)游离性氯-包括 HOCl、ClO -等。 我国生活饮用水卫生标准中规定集中式给水出厂的游离氯含量不低于 0.3mg/L,管网末梢 水不低于 0.05mg/L。 加入水中的氯量称为加氯量,将加氯量减去余氯量即是水样的需氯量。 一、自来水中余氯的测定 方法原理 采用碘量滴定法。余氯在酸姓介质中与碘化钾作用,生成定量的碘,再以硫代硫酸钠标准 溶液滴定。本法测定值为总余氯,包括 NH2Cl、HOCl、ClO -及 NHCl2; 反应方程式为: ClO -+ 2l -+ 2H+ = l2 + Cl -+ H2O l2+2S2O 2- 4+ 4H+ = 2l - + S4O6 2-+ 2H2O 1.仪器 碱式滴定管(50ml) 碘量瓶(或 250ml 具塞三角瓶) 2.测试步骤 自来水中不含高铁及亚硝酸盐,故可直接测定。在 250ml 碘量瓶中(或三角瓶中)放置 0.5g 碘化钾,加 10ml 稀硫酸,准确量取流动水样 100ml(打开自来水龙头,待水流数十秒后 再取水样)置于碘量瓶或具塞三角瓶中,迅速塞上塞摇动,见水样呈淡黄色,加 1ml 淀粉溶 液变蓝,则说明水样中有余氯,以标准硫代硫酸钠溶液滴定,至溶液蓝色消失呈无色透明溶 液,记下硫代硫酸钠溶液的体积。 3.计算 总余氯(Cl,mg.L -1)=V1×M×70.91×1000/V V1-硫代硫酸钠标准溶液的体积(ml) M-硫代硫酸钠标准溶液浓度(mol.L -1) V-自来水水样的体积(ml) 4.试剂 (1)分析纯的碘化钾(要求不含游离碘及碘酸钾) (2)近似 0.01 或 0.005mol.L -1 硫代硫酸钠溶液,当水中余氯量低于 1mg.L -1 时用 0.005mol.L -1 的稀溶液滴定。 (3)0.5%淀粉溶液 (4)1:4的硫酸 (5)醋酸盐缓冲溶液(pH=4),水样中有高铁及亚硝酸盐及锰时,可用该缓冲溶液进行酸化

使pH值在3.5-4.5之间。 二、疏代硫酸钠溶液的标定 疏代疏酸钠(NaS,0.H,0) 易风化、湖解 因此 不能用直接法配制标准溶液,只能先配制成近似浓度的溶液, 3天,再进行标定。 标定方法:准确称取0.1500g重铬酸钾(此重铬酸钾需在烘箱中120℃烘干2h取出冷却备用) 加30ml去离子水溶解,然后转移到250ml锥形瓶内,加水稀释至100ml左右,加20%的KI 溶液10ml,5ml1:1HC1,在暗处放置5min,用己配制好的0.01m01.L1的硫代硫酸钠溶液 滴定,当溶液呈黄绿色停止滴定,加入510.5%的淀粉溶液,摇均匀后继续滴定,当溶液突 然变成透明的亮绿色溶液,立即停止滴定,记下所用硫代硫酸钠溶液的体积 反应方程:Cr:0,+6I+14H=31:十2Cr(绿色)+7H:0 3I,+6S,0,=6I+3S,0 代硫酸钠溶液浓度计算 MV=W×60000/KCr0 式中: W一-称取重铬酸钾的重量 M一一硫代硫酸钠溶液浓度(标定》 V一一硫代硫酸钠溶液体积(ml) K,Cr,0,-摩尔质量 实验七加典盐中含碘量的测定 本实验所测定的加雕盐加入的是确酸钾。一船采用大约0.005-0.01的剂量,即在1kg时 食盐中加入50-100mg碘酸钾 ,我们在实验中测试的加碘食盐, 是中盐北京市盐业公司生产的 市售碘食盐。产品说明书上表明加入碘化钾的量是:20-50mg. 1.方法原理 采用碘量法。碘酸钾在酸性条件下与碘化钾发生反应,有碘单质生成。碘使淀粉变为蓝色。 再用已标定的硫代硫酸钠溶液滴定,将碘还原,溶液蓝色消失,记下硫代硫酸钠的体积,其 体积与碘酸钾的量成正比」 反应方程 I0,+51+6*=3L2+3H,0-① 3I+6S,0,→6I+3S,0。-② 2.试剂 (1)标准碳化钾溶液:准确称取0.0225g分析纯的碘酸钾,加入少量蒸馏水溶解,移入50m1 容量瓶(450μg·m1),用蒸馏水稀释至标线,摇匀备用。 (2)0.01g,n1化钾溶液 (3)1+1H1溶液 (4)0.2%淀粉溶液
使 pH 值在 3.5-4.5 之间。 二、硫代硫酸钠溶液的标定 硫代硫酸钠(Na2S2O3.H2O)一般都含有少量杂质,如 S、Na2SO3、Na2SO4、Na2CO3 等,同时 易风化、潮解。因此,不能用直接法配制标准溶液,只能先配制成近似浓度的溶液,放置2 -3天,再进行标定。 标定方法:准确称取 0.1500g 重铬酸钾(此重铬酸钾需在烘箱中 120℃烘干2h 取出冷却备用), 加 30ml 去离子水溶解,然后转移到 250ml 锥形瓶内,加水稀释至 100ml 左右,加 20%的 KI 溶液 10ml,5ml1:1HCl,在暗处放置 5min,用已配制好的 0.01mol.L -1 的硫代硫酸钠溶液 滴定,当溶液呈黄绿色停止滴定,加入 5ml0.5%的淀粉溶液,摇均匀后继续滴定,当溶液突 然变成透明的亮绿色溶液,立即停止滴定,记下所用硫代硫酸钠溶液的体积。 反应方程:Cr2O 2- 7+6I -+14H +=3I2+2Cr 3+(绿色)+7H2O 3I2+6S2O3 2-=6I -+3S4O6 2- 硫代硫酸钠溶液浓度计算: MV=W×60000/K2Cr2O7 式中: W-称取重铬酸钾的重量 M-硫代硫酸钠溶液浓度(标定) V-硫代硫酸钠溶液体积(ml) K2Cr2O7-摩尔质量 实验七 加碘盐中含碘量的测定 本实验所测定的加碘盐加入的是碘酸钾。一般采用大约 0.005-0.01%的剂量,即在 1kg 时 食盐中加入 50-100mg 碘酸钾。我们在实验中测试的加碘食盐,是中盐北京市盐业公司生产的 市售碘食盐。产品说明书上表明加入碘化钾的量是:20-50mg.kg -1 1.方法原理 采用碘量法。碘酸钾在酸性条件下与碘化钾发生反应,有碘单质生成。碘使淀粉变为蓝色。 再用已标定的硫代硫酸钠溶液滴定,将碘还原,溶液蓝色消失,记下硫代硫酸钠的体积,其 体积与碘酸钾的量成正比。 反应方程: IO - 3+5I -+6H+ =3I2+3H2O-① 3I2+6S2O 2- 3→6I -+3S4O 2- 6-② 2.试剂 (1)标准碘化钾溶液:准确称取 0.0225g 分析纯的碘酸钾,加入少量蒸馏水溶解,移入 50ml 容量瓶(450μg .ml -1),用蒸馏水稀释至标线,摇匀备用。 (2)0.01g.ml -1 碘化钾溶液 (3)1+1HCl 溶液 (4)0.2%淀粉溶液
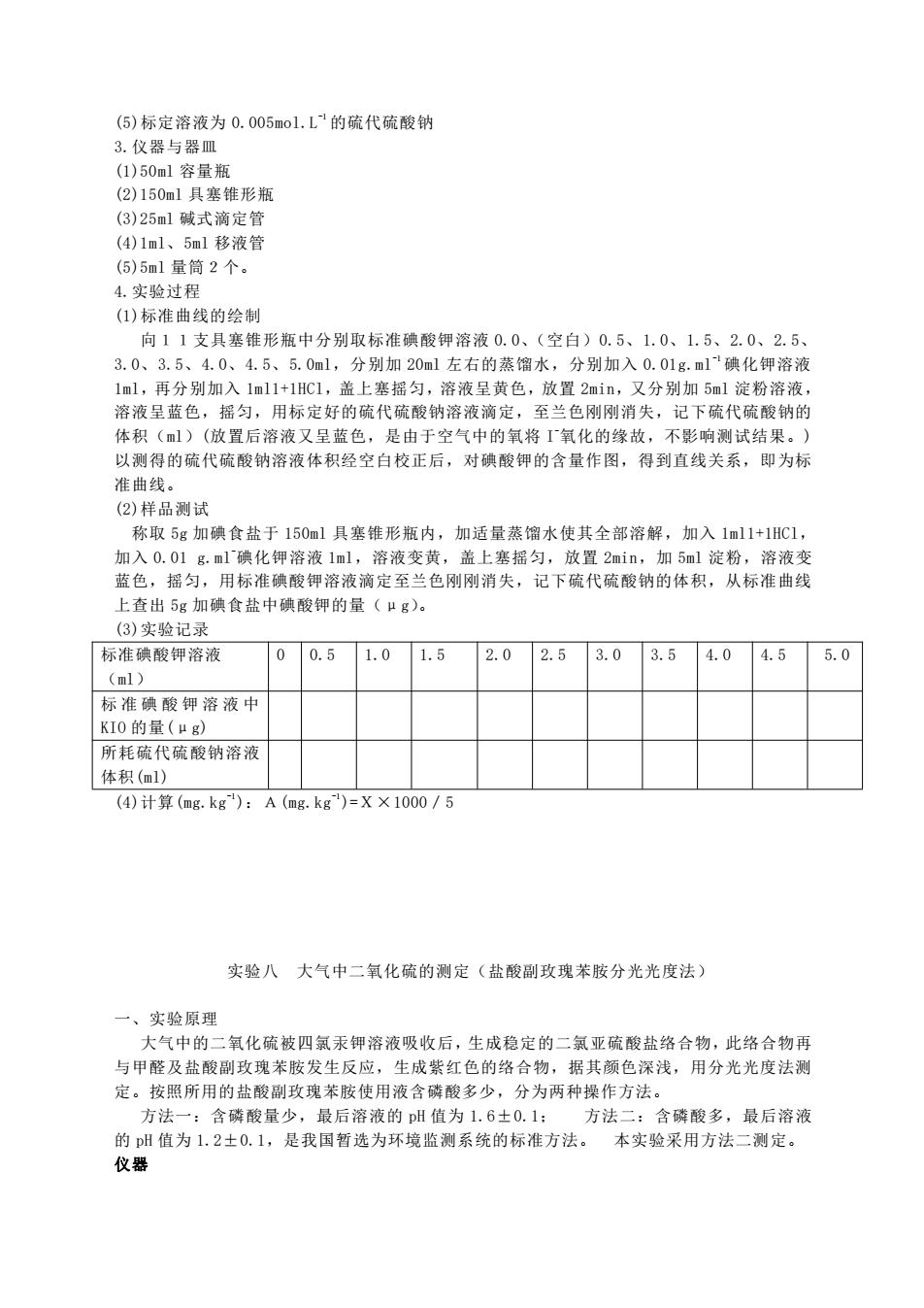
(⑤)标定溶液为0.005mol.L的硫代硫酸钠 3.仪器与器皿 (1)50m1容量瓶 (2)150m1具塞维形瓶 (3)25m1碱式滴定管 (4)1ml、5ml移液管 (5)5m1量筒2个. 4.实验过程 (1)标准曲线的绘制 向11支具塞维形瓶中分别取标准碘酸钾溶液0.0、(空白)0.5、1.0、1.5、2.0、2.5、 3.0、3.5、4.0、4.5、5.0ml,分别加20ml左右的蒸馏水,分别加入0.01g.ml碘化钾溶液 1ml,再分别加入1m11+1HC1,盖上塞摇匀,溶液呈黄色,放置2min,又分别加5ml淀粉溶液 溶液呈蓝色,摇匀,用标定好的硫代硫酸钠溶液滴定,至兰色刚刚消失,记下硫代硫酸钠的 体积(m1)(放置后溶液又呈蓝色,是由于空气中的氧将氧化的缘故,不影响测试结果。) 以测得的硫代硫酸钠溶液体积经空白校正后,对碘酸钾的含量作图,得到直线关系,即为标 准曲线 (2)样品测试 称取5g加碘食盐于150ml具塞锥形瓶内,加适量蒸馏水使其全部溶解,加入1ml1+1HC1, 加入0.01g.ml'碘化钾溶液1ml,溶液变黄,盖上塞摇匀,放置2min,加5ml淀粉,溶液变 蓝色,摇匀,用标准碘酸钾溶液滴定至兰色刚刚消失,记下硫代硫酸钠的体积,从标准曲线 上查出5g加碳食盐中碘酸钾的量(g) (3)实验记录 标准碘酸钾溶液 0 0.5 1.01.5 2.02.53.0 3.54.04.5 5.0 (m1) 标准碘酸钾溶液中 KI0的量(μg 所耗硫代硫酸钠溶视 体积(m1) (4)计算(mg.kg):A(mg.kg)=XX1000/5 实验八大气中二氧化硫的测定(盐酸副玫瑰苯胺分光光度法) 一、实验原理 大气中的二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,此络合物再 与甲醛及盐酸副玫瑰苯胺发生反应,生成紫红色的络合物,据其颜色深浅,用分光光度法测 定。按照所用的盐酸副玫瑰苯胺使用液含磷酸多少,分为两种操作方法。 方注 含磷酸量少,最后 液的pH值为1.6±0.1 方 含磷酸多,最后溶液 的H值为1.2士0.1,是我国暂选为环境监测系统的标准方法。 本实验采用方法二测定。 仪器
(5)标定溶液为 0.005mol.L -1 的硫代硫酸钠 3.仪器与器皿 (1)50ml 容量瓶 (2)150ml 具塞锥形瓶 (3)25ml 碱式滴定管 (4)1ml、5ml 移液管 (5)5ml 量筒2个。 4.实验过程 (1)标准曲线的绘制 向11支具塞锥形瓶中分别取标准碘酸钾溶液 0.0、(空白)0.5、1.0、1.5、2.0、2.5、 3.0、3.5、4.0、4.5、5.0ml,分别加 20ml 左右的蒸馏水,分别加入 0.01g.ml -1 碘化钾溶液 1ml,再分别加入 1ml1+1HCl,盖上塞摇匀,溶液呈黄色,放置 2min,又分别加 5ml 淀粉溶液, 溶液呈蓝色,摇匀,用标定好的硫代硫酸钠溶液滴定,至兰色刚刚消失,记下硫代硫酸钠的 体积(ml)(放置后溶液又呈蓝色,是由于空气中的氧将 I -氧化的缘故,不影响测试结果。) 以测得的硫代硫酸钠溶液体积经空白校正后,对碘酸钾的含量作图,得到直线关系,即为标 准曲线。 (2)样品测试 称取 5g 加碘食盐于 150ml 具塞锥形瓶内,加适量蒸馏水使其全部溶解,加入 1ml1+1HCl, 加入 0.01 g.ml -碘化钾溶液 1ml,溶液变黄,盖上塞摇匀,放置 2min,加 5ml 淀粉,溶液变 蓝色,摇匀,用标准碘酸钾溶液滴定至兰色刚刚消失,记下硫代硫酸钠的体积,从标准曲线 上查出 5g 加碘食盐中碘酸钾的量(μg)。 (3)实验记录 标准碘酸钾溶液 (ml) 0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 标 准 碘 酸 钾 溶 液 中 KIO 的量(μg) 所耗硫代硫酸钠溶液 体积(ml) (4)计算(mg.kg -1):A(mg.kg -1)=X×1000/5 实验八 大气中二氧化硫的测定(盐酸副玫瑰苯胺分光光度法) 一、实验原理 大气中的二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,此络合物再 与甲醛及盐酸副玫瑰苯胺发生反应,生成紫红色的络合物,据其颜色深浅,用分光光度法测 定。按照所用的盐酸副玫瑰苯胺使用液含磷酸多少,分为两种操作方法。 方法一:含磷酸量少,最后溶液的 pH 值为 1.6±0.1; 方法二:含磷酸多,最后溶液 的 pH 值为 1.2±0.1,是我国暂选为环境监测系统的标准方法。 本实验采用方法二测定。 仪器

1.多孔玻板吸收管(用于短时间采样):多孔玻板吸收瓶(用于24h采样)。 2.空气采样器:流量0-1L/min。 3.分光光度计。 试剂 1.0.04mol1/L四氯汞钾吸收液:称取10.9g氯化汞(HgC1)、6.0g氯化钾和0.070g乙 胺四乙酸二钠盐(EDTA-Na,),溶解于水,稀释至1000ml。此溶液在密闭容器中心存,可稳定 6个月。如发现有沉淀,不能再用。 2.2.0g/几L甲醛溶液:量取36-38%甲醛溶液1.1ml,用水稀释至200m1,临用现配。 3.6.0g/L氨基磺酸铵溶液:称取0.60g氨基磺酸铵“(,S0,),溶解于100ml水中,临用 现配 0.碘贮备液(Cal:=0.1mol/几):称取12.7g碘于烧杯中,加入40g碘化钾和25ml水,搅拌 至全部溶解后,用水稀释至1000l,贮存于棕色试剂瓶中。 1.碘使用液(Chl,=0.01mol/L),量取50ml碘贮备液,用水稀释至500ml,贮于棕色试剂瓶 2.2g/L淀粉指示剂:称取0.20g可溶性淀粉 用少量水调成糊状,慢慢倒入100ml沸水中 继续煮沸直至溶液澄清,冷却后贮于试剂瓶中 3.碘酸钾标准溶液:(CvK10,=0.1000mol/儿)称取3.5668g碘酸钾(优质纯,110℃烘干2h), 溶解于水,移入1000ml容量瓶中用水稀释至标线。 4.盐酸溶液(C=1.2mo1/L):量取100m1浓盐酸,用水稀释至1000m1 5.硫代硫酸钠贮备液:(CNa,S0,=0.1mol/L)称取25g硫代硫酸钠(Na,S0.5H,0),溶解于1000m1 新煮沸并已冷却的水 0.20g无水碳酸钠,贮于棕色瓶中, 放置 一周后标定其浓度 若溶液呈现浑浊时,应该过滤。 标定方法:吸取碘酸钾标准溶液25.00ml,置于250ml的碘量瓶中,加70m1新煮沸并已 冷却的水,加1.0g碘化钾,振荡至完全溶解后,再加1.2mo1/L盐酸溶液10.0ml,立即盖好 瓶塞,混匀。在暗处放置5mi后,用硫代硫酸钠溶液滴定至淡黄色,加淀粉指示剂5ml 继续滴定至亮绿色,按下式计算硫代硫酸钠溶液的浓度: C=25.00× 1000/ 式中:C-硫代硫酸钠溶液的浓度(mo1/L) 一消耗硫代疏酸钠溶液的体积(l) 6.硫代硫酸钠标准溶液:取50.00m1硫代硫酸钠贮备液于500m1容量瓶中,用新煮沸并已 冷却的水稀释至标线,计算其准确浓 7. 亚硫酸钠标准溶液 称取0.20g亚硫酸钠及0.010g乙二胺四乙酸二钠,将其溶解于200m】 新煮沸并已冷却的水中,轻轻摇匀(避免振荡,以防充氧)。放置2一3h后标定。此溶 液每毫升相当于含320-400μg二氧化疏。 标定方法:取四个250m1碘量瓶A、B、C、D,分别加入0.010mo1/L碘溶液50.00ml。在 A、B瓶内名加25m1水,在C瓶内加入25.00m1亚硫酸纳标准溶液,盖好瓶塞。立即吸取2.00m1 亚硫酸钠标准溶液于已加有40-50m1四氯汞钾溶液的1001容量瓶中,使其生成稳定的二氯 亚硫酸盐络合 物 再吸取25.00ml亚硫酸钠标准溶液于D瓶内,盖好瓶塞。然后用四氯汞钾 吸收液将100m1容量瓶中的溶液稀释至标线。 A、B、C、D四瓶于暗处放置5min后,用0.01mol/L疏代硫酸钠标准溶液滴定至淡黄色,加 5m1淀粉指示剂,继续滴定至蓝色刚好退去。平行滴定所用疏代硫酸钠标准溶液的体积之差 应不大于0.05m1 所配100l容量瓶中的亚硫酸钠标准溶液相当于二氧化硫的浓度由下式计算 S0,(μg/ml)=[(。-V)×C×32.02×1000/25.00]×2.00/100 式中:V。-一滴定A瓶时所用硫代硫酸钠标准溶液的体积的平均值(m1):
1.多孔玻板吸收管(用于短时间采样);多孔玻板吸收瓶(用于 24h 采样)。 2.空气采样器:流量 0-1L/min。 3.分光光度计。 试剂 1.0.04mol/L 四氯汞钾吸收液:称取 10.9g 氯化汞(HgCl2)、6.0g 氯化钾和 0.070g 乙二 胺四乙酸二钠盐(EDTA-Na2),溶解于水,稀释至 1000ml。此溶液在密闭容器中贮存,可稳定 6 个月。如发现有沉淀,不能再用。 2.2.0g/L 甲醛溶液:量取 36-38%甲醛溶液 1.1ml,用水稀释至 200ml,临用现配。 3.6.0g/L 氨基磺酸铵溶液:称取 0.60g 氨基磺酸铵"(H2NSO3NH4),溶解于 100ml 水中,临用 现配。 0. 碘贮备液(C1/2l2=0.1mol/L):称取 12.7g 碘于烧杯中,加入 40g 碘化钾和 25ml 水,搅拌 至全部溶解后,用水稀释至 1000ml,贮存于棕色试剂瓶中。 1. 碘使用液(C1/2l2=0.01mol/L),量取 50ml 碘贮备液,用水稀释至 500ml,贮于棕色试剂瓶 中。 2. 2g/L 淀粉指示剂:称取 0.20g 可溶性淀粉,用少量水调成糊状,慢慢倒入 100ml 沸水中, 继续煮沸直至溶液澄清,冷却后贮于试剂瓶中。 3. 碘酸钾标准溶液:(C1/6KlO3=0.1000mol/L)称取 3.5668g 碘酸钾(优质纯,110℃烘干 2h), 溶解于水,移入 1000ml 容量瓶中用水稀释至标线。 4. 盐酸溶液(CHCl=1.2mol/L):量取 100ml 浓盐酸,用水稀释至 1000ml。 5. 硫代硫酸钠贮备液:(CNa2SO3=0.1mol/L)称取 25g 硫代硫酸钠(Na2SO3.5H2O),溶解于 1000ml 新煮沸并已冷却的水中,加 0.20g 无水碳酸钠,贮于棕色瓶中,放置一周后标定其浓度。 若溶液呈现浑浊时,应该过滤。 标定方法:吸取碘酸钾标准溶液 25.00ml,置于 250ml 的碘量瓶中,加 70ml 新煮沸并已 冷却的水,加 1.0g 碘化钾,振荡至完全溶解后,再加 1.2mol/L 盐酸溶液 10.0ml,立即盖好 瓶塞,混匀。在暗处放置 5min 后,用硫代硫酸钠溶液滴定至淡黄色,加淀粉指示剂 5ml ,继续滴定至亮绿色,按下式计算硫代硫酸钠溶液的浓度: C=25.00×0.1000/V 式中:C-硫代硫酸钠溶液的浓度(mol/L) V-消耗硫代硫酸钠溶液的体积(ml) 6. 硫代硫酸钠标准溶液:取 50.00ml 硫代硫酸钠贮备液于 500ml 容量瓶中,用新煮沸并已 冷却的水稀释至标线,计算其准确浓度。 7. 亚硫酸钠标准溶液:称取 0.20g 亚硫酸钠及 0.010g 乙二胺四乙酸二钠,将其溶解于 200ml 新煮沸并已冷却的水中,轻轻摇匀(避免振荡,以防充氧)。放置2-3h后标定。此溶 液每毫升相当于含 320-400μg 二氧化硫。 标定方法:取四个 250ml 碘量瓶 A、B、C、D,分别加入 0.010mol/L 碘溶液 50.00ml。在 A、B 瓶内各加 25ml 水,在 C 瓶内加入 25.00ml 亚硫酸钠标准溶液,盖好瓶塞。立即吸取 2.00ml 亚硫酸钠标准溶液于已加有 40-50ml 四氯汞钾溶液的 100 ml 容量瓶中,使其生成稳定的二氯 亚硫酸盐络合物。再吸取 25.00ml 亚硫酸钠标准溶液于 D 瓶内,盖好瓶塞。然后用四氯汞钾 吸收液将 100ml 容量瓶中的溶液稀释至标线。 A、B、C、D 四瓶于暗处放置 5min 后,用 0.01mol/L 硫代硫酸钠标准溶液滴定至淡黄色,加 5ml 淀粉指示剂,继续滴定至蓝色刚好退去。平行滴定所用硫代硫酸钠标准溶液的体积之差 应不大于 0.05ml。 所配 100ml 容量瓶中的亚硫酸钠标准溶液相当于二氧化硫的浓度由下式计算: SO2(μg/ml)=[(V0-V)×C×32.02×1000/25.00]×2.00/100 式中:V0-滴定A瓶时所用硫代硫酸钠标准溶液的体积的平均值(ml);

V-一滴定B瓶时所用硫代硫酸钠标准溶液的体积的平均值(1): C-一硫代硫酸钠标准溶液的准确浓度(mo1/儿) 32.02-相当于1mm01/九硫代疏酸钠溶液的一氧化随(1/2S0,)的质量(mg) 根据以上计算的二氧化硫标准溶液的浓度,再用四氯汞钾吸收液稀释成每毫升含2.0μ8 二氧化硫的标准溶液, 此溶液用于绘制 乐准曲线 王冰箱中存放 可稳定 12.0.2%盐酸副玫瑰苯胺(PRA,即对品红)贮备液:称取0.20g经提纯的盐酸副玫瑰苯胺,溶解 于100ml1.0mo1/L盐酸溶液中。 13.磷酸溶液(CHP0,=3mo1/L:量取41mL85%浓磷酸,用水稀释至200m1 14.0.016%盐酸副致政装胺使用液,吸取02%盐酸副孜速苯胺产各液20.00m1于250m1容量 瓶中,加3mo1/L磷酸溶液200m1,用水稀释至标线 。至少放置24h方可使用。存于暗处, 稳定9个月 测定步 1.标准曲线的绘制:取8支10ml具塞比色管,按下表所列参数配制标准色阶。 加入溶液 色列管编号 2 4 6 2.0μg/m1亚硫酸钠标准溶液(m1)0 0.601.001.401.601.802.202.70 四氯汞钾吸收液(m1) 5.004.404.003.603.403.202.802.30 二氧化硫含量(μg 01.22.02.83.23.64.45.4 在以上各管中加入6.0g/L氨基磺酸铵溶液0.50ml,摇匀。再加2.0g/L甲醛溶液0.50ml 及0.016%盐酸副玫瑰苯胺使用液1.50ml,摇匀。当室温为15-20℃时,显色30min:室温为 20-25℃时,显色20min:室温为25-30℃时,显色15min。用比色皿于575nm波长处以水为 参比,测定吸光度。以吸光度对二氧化硫含量(μg)绘制标准曲线,或用最小二乘法计算出回 归方程式。 (1)短时间采样:用内装5ml四氯汞钾吸收液的多孔玻璃吸收管以0.5L/mi流量采样 10-20L. (2)24h采样:测定24h平均浓度时,用内装50m1吸收液的多孔玻璃板吸收瓶以0.2L/min 流量,10-16℃恒温采样 3.样品测定:样品浑浊时, 离心分离去除。采样后样品放置 20min 以使臭氧分解 (1)短时间样品:将吸收管中的吸收液全部移入10ml具塞比色管内,用少量水洗涤吸收管, 洗涤液并入具塞比色管中,使总体积为5m1。加6.0g/L氨基磺酸按溶液0.50m1,摇匀。 放置1Omi,以除去氮氧化物的干扰。以下步骤同标准曲线的绘制。 (2)24样品:将采集样品后的吸收液移入50.0m1容量瓶中,用少量水洗涤吸收瓶,洗涤 液并入容量瓶中 使溶液总体积为50.0ml,摇匀。吸取适量样品溶液置于10ml具塞 色管 用吸收液定容为5.00 以下步骤同短时间样品测定 计算 二氧化质(S02,mg/m)=(N/V.)×(V/V.) 式中 -一一测定时所取样品溶液中二氧化硫含量(μg,由标准曲线查知): V.=-标准状态下的采样体积(L) -一样品溶液总体积(m) 测定时所取样品溶液体积(l 注意事 1温度对显色影响较大,温度越高,空白值越大。温度高时显色快,褪色也快,最好用恒温
V-滴定B瓶时所用硫代硫酸钠标准溶液的体积的平均值(ml); C-硫代硫酸钠标准溶液的准确浓度(mol/L) 32.02-相当于 1mmol/L 硫代硫酸钠溶液的二氧化硫(1/2 SO2)的质量(mg) 根据以上计算的二氧化硫标准溶液的浓度,再用四氯汞钾吸收液稀释成每毫升含 2.0μg 二氧化硫的标准溶液,此溶液用于绘制标准曲线,在冰箱中存放,可稳定 20 天。 12.0.2%盐酸副玫瑰苯胺(PRA,即对品红)贮备液:称取 0.20g 经提纯的盐酸副玫瑰苯胺,溶解 于 100ml1.0mol/L 盐酸溶液中。 13.磷酸溶液(CH3PO4=3mol/L:量取 41mL85%浓磷酸,用水稀释至 200ml。 14.0.016%盐酸副玫瑰苯胺使用液:吸取 0.2%盐酸副玫瑰苯胺贮备液 20.00ml 于 250ml 容量 瓶中,加 3mol/L 磷酸溶液 200ml,用水稀释至标线。至少放置 24h 方可使用。存于暗处,可 稳定 9 个月。 测定步骤 1.标准曲线的绘制:取8支 10ml 具塞比色管,按下表所列参数配制标准色阶。 加入溶液 色列管编号 0 1 2 3 4 5 6 7 2.0μg/ml 亚硫酸钠标准溶液(ml) 0 0.60 1.00 1.40 1.60 1.80 2.20 2.70 四氯汞钾吸收液(ml) 5.00 4.40 4.00 3.60 3.40 3.20 2.80 2.30 二氧化硫含量(μg) 0 1.2 2.0 2.8 3.2 3.6 4.4 5.4 在以上各管中加入 6.0g/L 氨基磺酸铵溶液 0.50ml,摇匀。再加 2.0g/L 甲醛溶液 0.50ml, 及 0.016%盐酸副玫瑰苯胺使用液 1.50ml,摇匀。当室温为 15-20℃时,显色 30min;室温为 20-25℃时,显色 20min;室温为 25-30℃时,显色 15min。用比色皿于 575nm 波长处以水为 参比,测定吸光度。以吸光度对二氧化硫含量(μg)绘制标准曲线,或用最小二乘法计算出回 归方程式。 采样 (1)短时间采样:用内装 5ml 四氯汞钾吸收液的多孔玻璃吸收管以 0.5L/min 流量采样 10-20L。 (2)24h 采样:测定 24h 平均浓度时,用内装 50ml 吸收液的多孔玻璃板吸收瓶以 0.2L/min 流量,10-16℃恒温采样。 3.样品测定:样品浑浊时,应离心分离去除。采样后样品放置 20min,以使臭氧分解。 (1)短时间样品:将吸收管中的吸收液全部移入 10ml 具塞比色管内,用少量水洗涤吸收管, 洗涤液并入具塞比色管中,使总体积为 5ml。加 6.0g/L 氨基磺酸铵溶液 0.50ml,摇匀。 放置 10min,以除去氮氧化物的干扰。以下步骤同标准曲线的绘制。 (2)24h 样品:将采集样品后的吸收液移入 50.0ml 容量瓶中,用少量水洗涤吸收瓶,洗涤 液并入容量瓶中,使溶液总体积为 50.0ml,摇匀。吸取适量样品溶液置于 10ml 具塞 比色管中,用吸收液定容为 5.00ml,以下步骤同短时间样品测定。 计算:二氧化硫(SO2,mg/m 3)=(W/Vn)×(Vb/Va) 式中 W-测定时所取样品溶液中二氧化硫含量(μg,由标准曲线查知); Vn-标准状态下的采样体积(L) Vb-样品溶液总体积(ml) Va-测定时所取样品溶液体积(ml) 注意事项 1.温度对显色影响较大,温度越高,空白值越大。温度高时显色快,褪色也快,最好用恒温