
1.3.醇的结构与物理性质 醇是由烃基和羟基两部分组成的,烃基的 结构我们以前己经学过了。在醇的羟基中 ,氧原子的外层电子比碳多了2个,因此其 电子构型为:2S22P4,氧原子采取SP3杂化 以 1↑川! 2P 2S SP3
1.3. 醇的结构与物理性质 - - - - - - - - 2S 2P SP3 醇是由烃基和羟基两部分组成的,烃基的 结构我们以前已经学过了。在醇的羟基中 ,氧原子的外层电子比碳多了2个,因此其 电子构型为:2S 22P4 ,氧原子采取SP3杂化 :
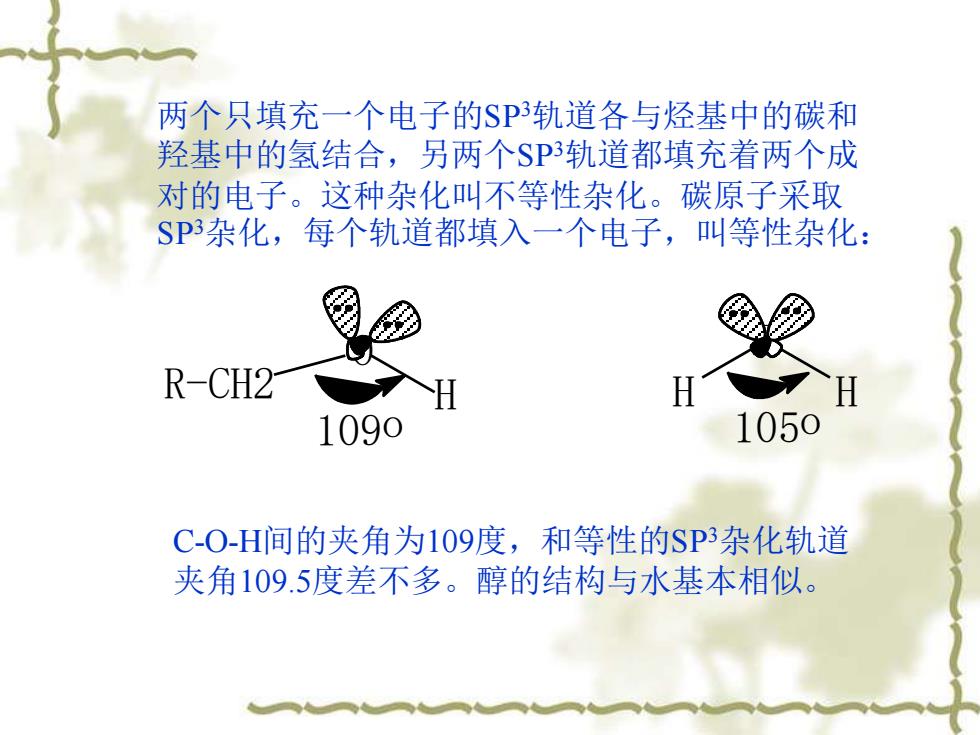
两个只填充一个电子的$P轨道各与烃基中的碳和 羟基中的氢结合,另两个SP3轨道都填充着两个成 对的电子。这种杂化叫不等性杂化。碳原子采取 SP3杂化,每个轨道都填入一个电子,1 叫等性杂化: R-CH2 1090 1050 C-O-H间的夹角为109度,和等性的SP3杂化轨道 夹角109.5度差不多。醇的结构与水基本相似
两个只填充一个电子的SP3轨道各与烃基中的碳和 羟基中的氢结合,另两个SP3轨道都填充着两个成 对的电子。这种杂化叫不等性杂化。碳原子采取 SP3杂化,每个轨道都填入一个电子,叫等性杂化: R-CH2 O H O H H 109o 105o C-O-H间的夹角为109度,和等性的SP3杂化轨道 夹角109.5度差不多。醇的结构与水基本相似
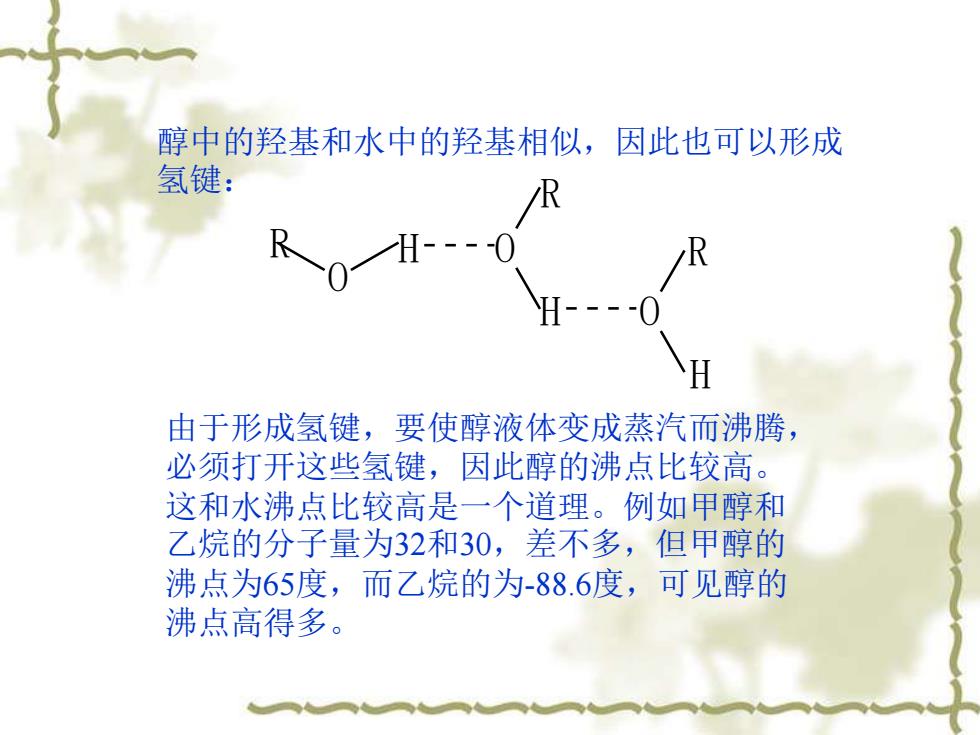
醇中的羟基和水中的羟基相似,因此也可以形成 氢键: R H- 由于形成氢键,要使醇液体变成蒸汽而沸腾, 必须打开这些氢键,因此醇的沸点比较高。 这和水沸点比较高是一个道理。例如甲醇和 乙烷的分子量为32和30,差不多,但甲醇的 沸点为65度,而乙烷的为-88.6度,可见醇的 沸点高得多
醇中的羟基和水中的羟基相似,因此也可以形成 氢键: O R H O R H O R H 由于形成氢键,要使醇液体变成蒸汽而沸腾, 必须打开这些氢键,因此醇的沸点比较高。 这和水沸点比较高是一个道理。例如甲醇和 乙烷的分子量为32和30,差不多,但甲醇的 沸点为65度,而乙烷的为-88.6度,可见醇的 沸点高得多

另外,由于醇中的羟基 可以同水形成氢键: 因此醇的水溶性好,低级醇(1-4个C)可以与 水混溶,而随着R-基的增大,醇分子中-OH的比 例减少,因此与水的相似性越差,水溶性也就 越差。这就是“相似相溶”规律。分子中的羟 基越多,形成的氢键的能力越大,因此沸点越 高,水溶性也越好。如乙二醇沸点197度,与水 混溶。 1.醇返回
H R H O R H O O H O R H 另外,由于醇中的羟基 可以同水形成氢键: 因此醇的水溶性好,低级醇(1-4个C)可以与 水混溶,而随着R-基的增大,醇分子中-OH的比 例减少,因此与水的相似性越差,水溶性也就 越差。这就是“相似相溶”规律。分子中的羟 基越多,形成的氢键的能力越大,因此沸点越 高,水溶性也越好。如乙二醇沸点197度,与水 混溶。 1. 醇返回