
3、酸碱反应由两个酸碱半反应构成例:HAc与NH,水中的反应半反应:+H+HAc -Ac-半反应:NH4+H++ NH H+总反应:HAc + NH,NH.Ac酸碱反应的实质一一酉酸碱间的质子授受过程质子的转移山东理工大字6SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 6 3、酸碱反应 酸碱反应的实质——酸碱间的质子授受过程 质子的转移 ——由两个酸碱半反应构成 总反应: HAc + NH3 NH4Ac H+ 半反应: H+ + NH3 NH4 + 半反应: HAc Ac- + H+ 例: HAc与NH3 水中的反应

酸碱反应类型与平衡常数1、溶剂分子之间的质子转移反应一质子自递反应H,O=H++OHH,O+H,0=H,0++OHK, =[H,O*J[OH ]=[H[OH ]=1×10-14SH+SH =SH,+SK, =[SH, ][S-]K一溶剂分子的质子自递常数山东翟工大学7HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 7 H2 O H2 O H3 O OH 1、溶剂分子之间的质子转移反应—质子自递反应 [SH ][S ] SH SH SH S 2 2 Ks K—溶剂分子的质子自递常数 1 4 [H3 O ][OH ] [H ][OH ] 1 10 Kw H2 O H OH 二、酸碱反应类型与平衡常数
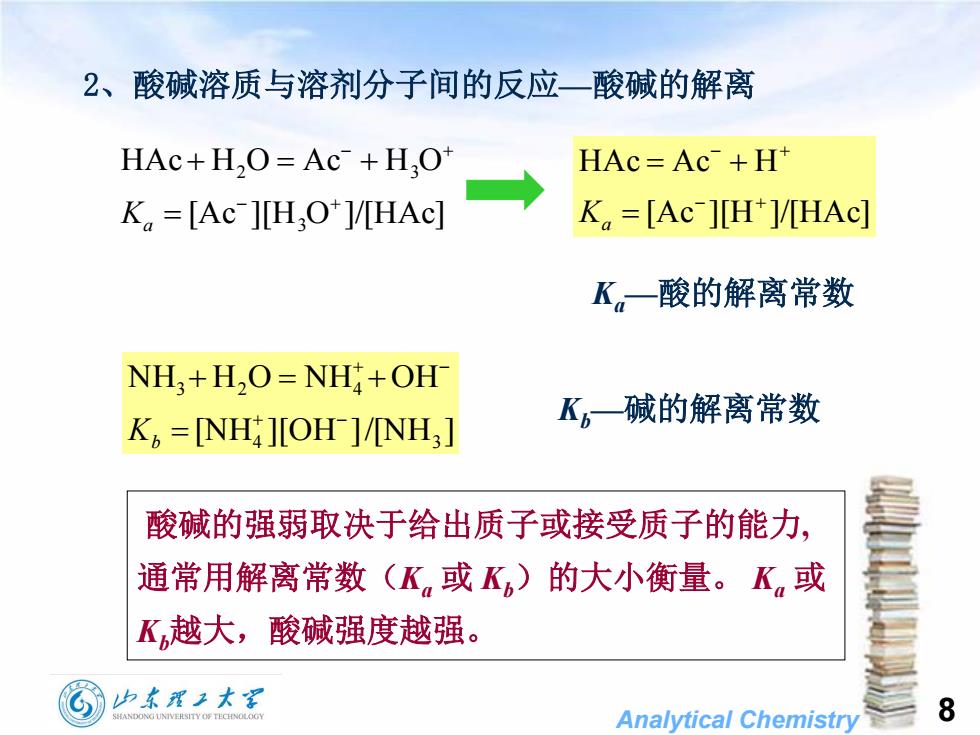
2、酸碱溶质与溶剂分子间的反应一酸碱的解离HAc=Ac-+HtHAc+H,O=Ac- +H,OK.=[Ac-1H+]/HAcK,=[Ac-][H,O+]/[HAc]K一酸的解离常数NH+H,O=NH +OHK一碱的解离常数K, =[NH][OH]/[NH,]酸碱的强弱取决于给出质子或接受质子的能力通常用解离常数的大小衡量。K,或(K,或K)K,越大,酸碱强度越强。山东翟工大8HANDONGUNIVERSITYOFTECHNOLOGAnalytical Chemistry
Analytical Chemistry 8 2、酸碱溶质与溶剂分子间的反应—酸碱的解离 [Ac ][H O ]/[HAc] HAc H O Ac H O 3 2 3 Ka [Ac ][H ]/[HAc] HAc Ac H Ka Ka—酸的解离常数 Kb—碱的解离常数 [NH ][OH ]/[NH ] NH H O NH OH 4 3 3 2 4 Kb 酸碱的强弱取决于给出质子或接受质子的能力, 通常用解离常数(Ka 或 Kb)的大小衡量。 Ka 或 Kb越大,酸碱强度越强
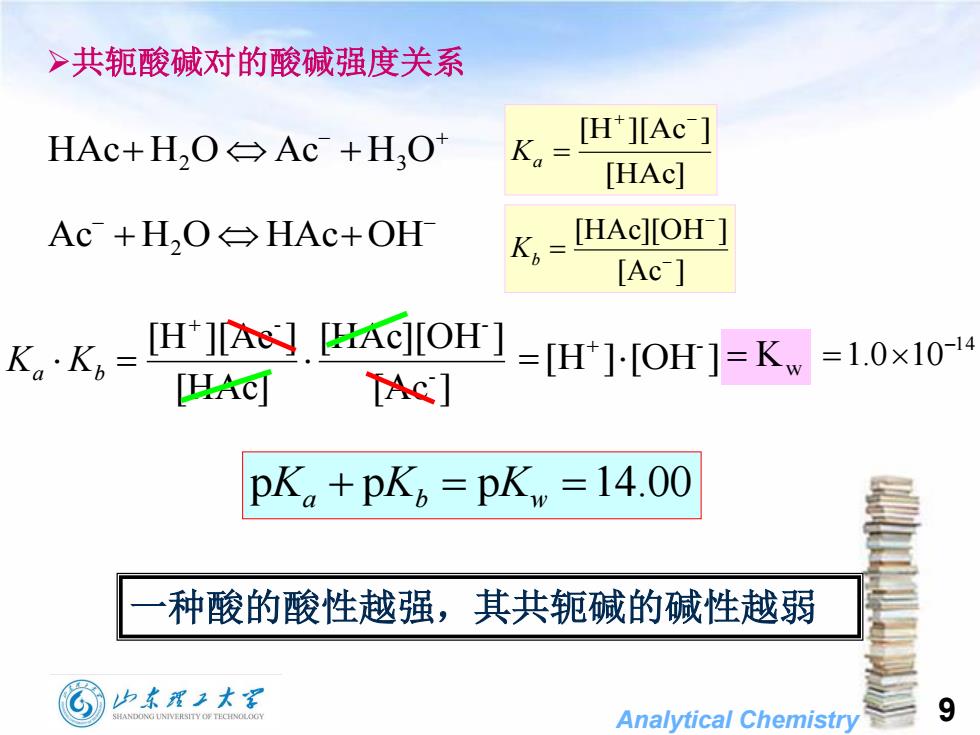
>共轭酸碱对的酸碱强度关系[H][AcHAc+H,O←Ac +H,OK[HAc][HAc][OH-Ac+H,O←HAc+OHKh[Ac][H+][A][HAc][OH]=1.0×10-14KK,:=[H+]·[OH] = K,一[Ac][HAc]pK. +pK, =pKw =14.00种酸的酸性越强,其共轭碱的碱性越弱山东翟工大学9SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 9 共轭酸碱对的酸碱强度关系 HAc H2 O Ac H3 O [HAc] [H ][Ac ] Ka Ac H2 O HAcOH [Ac ] [HAc][OH ] Kb [Ac ] [HAc][OH ] [HAc] [H ][Ac ] - - - Ka Kb [H ] [OH ] - Kw 14 1.0 10 pKa pKb pKw 14.00 一种酸的酸性越强,其共轭碱的碱性越弱
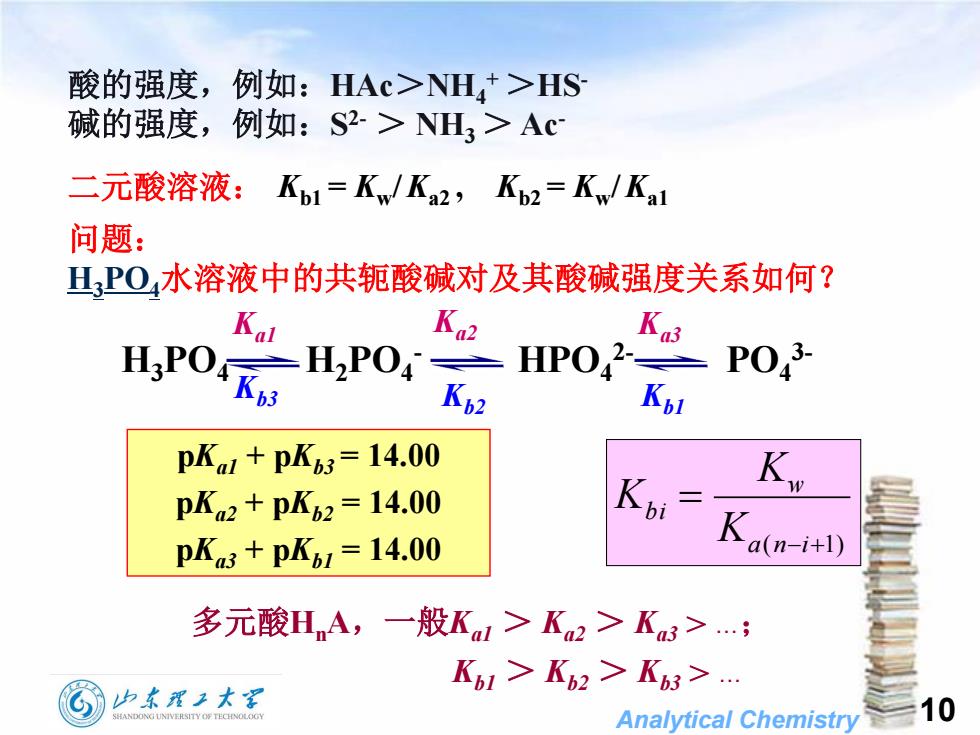
酸的强度,例如:HAc>NH+>HS碱的强度,例如:S2-> NH,>Ac二元酸溶液:Kb1= Kw/ Ka2,Kb2= Kw/ Kal问题:水溶液中的共轭酸碱对及其酸碱强度关系如何?H,POKa2Ka3KalPO,3-2HPO4H,POH,PO4Kb3Kp2KblpKal + pKb3 = 14.00KWKbipKa2 + pKb2=14.00Ka(n-i+1)pKa3 + pKb1 = 14.00多元酸H,A,一般Ka >Ka2 >Ka3>.…;Kbl > K2 > Kb3 >.山东理工大10HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 10 酸的强度,例如:HAc>NH4 + >HS- 碱的强度,例如:S 2- > NH3 > Ac- 问题: H3PO4水溶液中的共轭酸碱对及其酸碱强度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb2 Kb1 Kb3 Ka1 Ka2 Ka3 pKa1 + pKb3 = 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 ( 1) a n i w b i K K K 多元酸HnA,一般Ka1 > Ka2 > Ka3 > .; Kb1 > Kb2 > Kb3 > . 二元酸溶液: Kb1 = Kw /Ka2 , Kb2 = Kw /Ka1