
2.生成沉淀的影响(改变浓度比值) 氧化剂↓,E八,还原性 还原剂↓,E☑,氧化性刀 例如,碘量法测铜 E(Cu2+1Cu*)=0.17V,E(12/I)=0.54V 2Cu2++4r=2Cul↓+↓2 ]=1.0 mol-dm-3时, E(Cu2+/Cu*)=0.86V>E0(L2/I) 上页 页 目录 返回
上页 下页 目录 返回 2. 生成沉淀的影响 (改变浓度比值) 例如,碘量法测铜 [I – ]=1.0mol·dm–3时, (Cu /Cu ) 0.86V θ' 2 = + + E > ( / ) − I I 2 θ E 氧化剂 ↓, ↘,还原性↗ 还原剂↓, E θ' ↗,氧化性↗ θ' E - 2 2+ 2Cu +4I = 2CuI +I Cu Cu V, I I V θ 2 θ - ( / ) 0.17 ( / ) 0.54 = 2 = + + E E 2− S2 O3
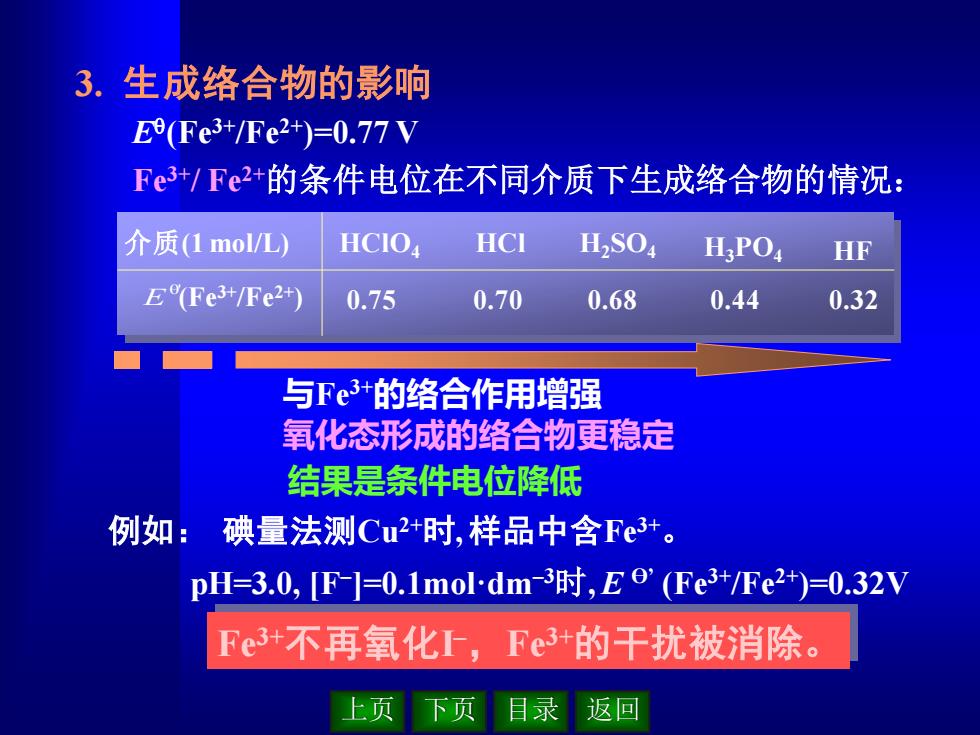
3.生成络合物的影响 E9(Fe3+/Fe2+)=0.77V Fe3+/Fe2+的条件电位在不同介质下生成络合物的情况: 介质(1mol/L) HCIO HCI H2S04 H,PO, HF E(Fe3+/Fe2+) 0.75 0.70 0.68 0.44 0.32 与Fe3+的络合作用增强 氧化态形成的络合物更稳定 结果是条件电位降低 例如:碘量法测Cu+时,样品中含Fe3。 pH=3.0,F-]=0.1 mol-dm-3时,Eo'(Fe3+/Fe2+)=0.32V Fe3+不再氧化,Fe3+的干扰被消除。 上页 下页 目录返回
上页 下页 目录 返回 3. 生成络合物的影响 E (Fe3+/Fe2+)=0.77 V Fe3+/ Fe2+的条件电位在不同介质下生成络合物的情况: 结果是条件电位降低 与Fe3+的络合作用增强 氧化态形成的络合物更稳定 例如: 碘量法测Cu2+时, 样品中含Fe3+ 。 pH=3.0, [F– ]=0.1mol·dm–3时, E Ө’ (Fe3+/Fe2+)=0.32V Fe3+不再氧化I –,Fe3+的干扰被消除。 0.75 0.70 0.68 0.44 0.32 介质(1 mol/L) H3PO4 HF (Fe3+/Fe2+) HClO4 HCl H2SO4 θ' E

4.溶液酸度的影响 ★cH)或c(OH)参加电极反应,直接影响电位值。 例H3AsO4 (2H 2e→HAs02+2H20 E=E[As(/As(Iml+ 0.059c(H*)c(H3As04 2 g c(HAsO2) ★影响Ox或Red的存在形式 E(As(V)/As(m)与pH的关系: [H+]=4 mol.dm-3 HAsO+2H++3F HAsO2+Is+2H2O pH=8 上页 下页 目录 返回
上页 下页 目录 返回 4. 溶液酸度的影响 ★ c(H+ )或c(OH– )参加电极反应, 直接影响电位值。 ★ 影响Ox或Red的存在形式 例 H3AsO4 + 2H+ + 2e- HAsO2 + 2H2O ( ) ( ) ( ) [ ( lg 2 2 θ 3 4 HAsO H H AsO 2 0.059 As V)/As(III)] c c c E E + = + [H+ ]=4 mol·dm–3 H3AsO4 + 2H+ + 3I– HAsO2 + I3 – + 2H2O pH=8 (As(V)/As(III))与pH的关系: θ' E

E(As(V/AsD)与pH的关系 (2.2) (7.0) (11.5) 0.8 0.6 H3AsO H2AsO -HAsO 2- 0.4 I AsO3- 0.3 0.2 0 -0.2 HAsO2 酸度影响反应方向 -0.4 pH89时, AsO2 -0.6 I可定量氧化As四 (9.2 0 10 12 4 mol-dm-3HCl介质中, As(V)可定量氧化T→I写 上页 下页 目录 返回
上页 下页 目录 返回 E θ' (As(V)/As(III))与pH的关系 酸度影响反应方向 pH 8~9时, 可定量氧化As(III) 4 mol·dm–3 HCl介质中, As(V)可定量氧化I –→ − 3 I − 3 I
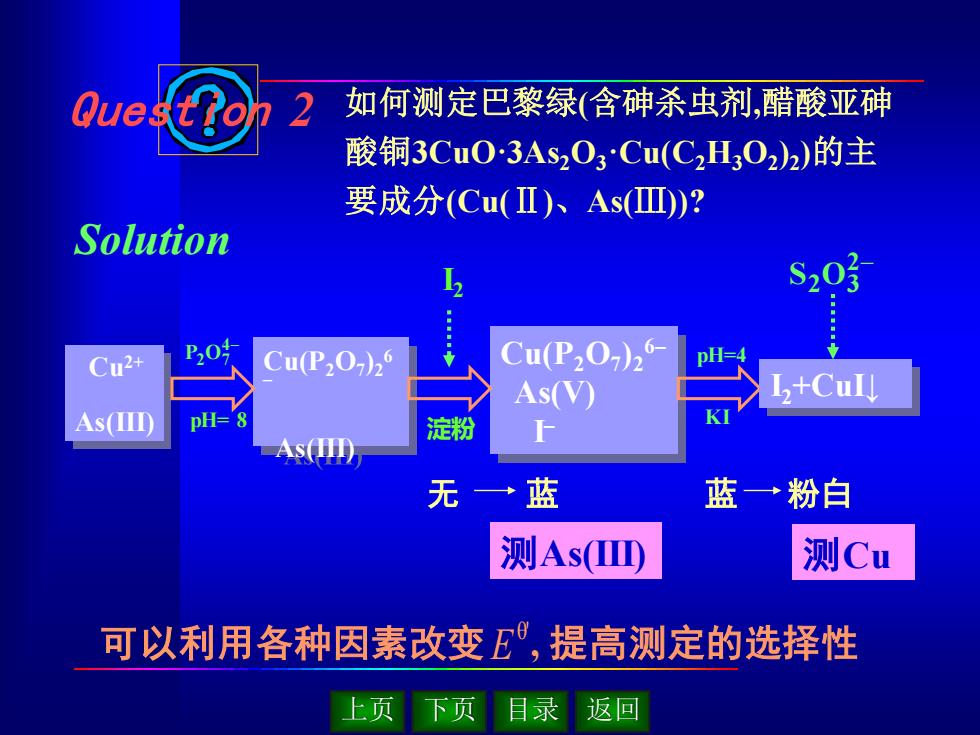
Que 2 如何测定巴黎绿(含砷杀虫剂,醋酸亚砷 酸铜3CuO3As2O3Cu(C2H3022)的主 要成分(Cu(Ⅱ)、As(Ⅲ)? Solution S203 Cu2+ P0 CuP207)2 Cu(P202)26 DH= As(V) L+CuIJ As() PH- 淀粉 As(H) 无一蓝 蓝一→粉白 测AsD 测Cu 可以利用各种因素改变E,提高测定的选择性 上页 页 目录 返回
上页 下页 目录 返回 Question 2 Solution 如何测定巴黎绿(含砷杀虫剂,醋酸亚砷 酸铜3CuO·3As2O3·Cu(C2H3O2 )2 )的主 要成分(Cu(Ⅱ)、As(Ⅲ))? 可以利用各种因素改变 E θ', 提高测定的选择性 无 蓝 测As(III) 测Cu 蓝 粉白 Cu2+ As(III) Cu(P2O7 )2 6 – As(III) Cu(P2O7 )2 6– As(V) I – pH=4 pH= 8 KI I2 淀粉 I2+CuI↓ 2− S2 O3 4− P2O7