
§5.1反丞的等温方翟 公式理解: a)在一个无限量的体系内,体系的发生一个mo变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d引起体系发 生一个dG的变化。 对△,Gm的理解: 1)量纲:J.mo1 2)强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4) 随着反应的进行,由于浓度发生变化,则发生变化,引起变 化,所以不是一个定值。 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 公式理解: a) 在一个无限量的体系内,体系的发生一个mol变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发 生一个dG的变化。 对 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变 化,所以不是一个定值。 r m G

§5.1反爱的等温方程 多相反应若各相组成恒定如: A(s)=B(g)+C(g), +RTIn (P/P 各组分化学势与反应进度无关,摩尔Gibbs函数 也与无关.即系统的G为一直线。其斜率△G 为负,A>0,正向反应可以自发进行,一直到 底; 为零,A=0, 处于化学平衡; 为正,A<0 正向反应不可能进行。 上页 下页 回主目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 多相反应若各相组成恒定如: A(s)===B(g)+C(g), B =B ⊝ +RTln(PB /P ⊝ ) 各组分化学势与反应进度无关,摩尔Gibbs函数 也与无关. 即系统的G-为一直线。其斜率r Gm 为负,A>0, 正向反应可以自发进行,一直到 底; 为零,A=0, 处于化学平衡; 为正,A<0 正向反应不可能进行。 G
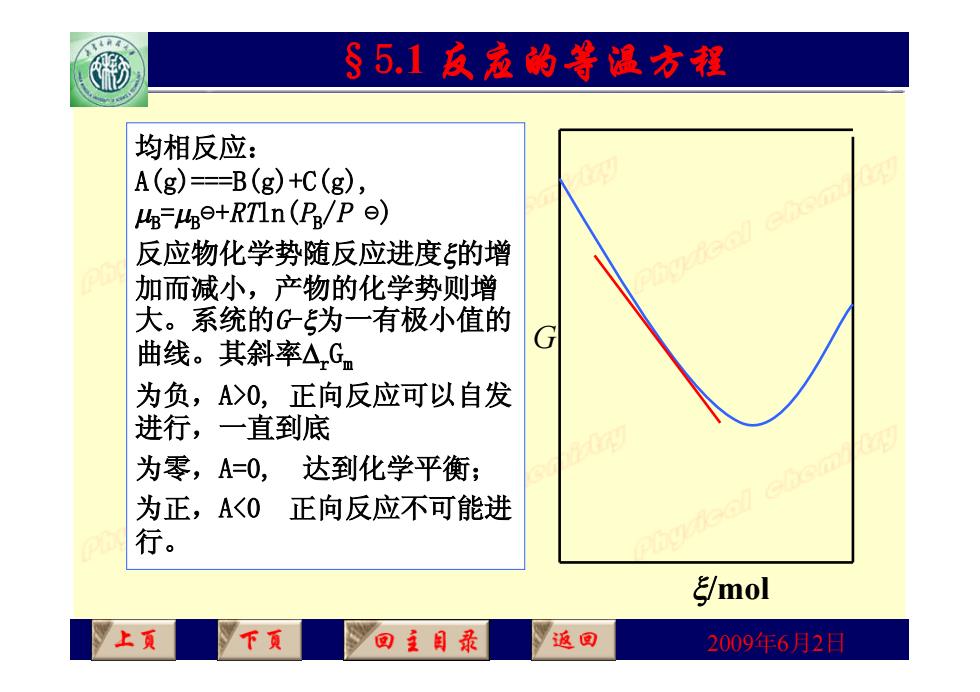
§5.1反丞的等温方翟 均相反应: A(g)==B(g)+C(g), uB-uge+RTIn(P/P 反应物化学势随反应进度的增 加而减小,产物的化学势则增 大。系统的G为一有极小值的 曲线。其斜率△Gn G 为负,A>0,正向反应可以自发 进行,一直到底 为零,A=0, 达到化学平衡; 为正,A<0 正向反应不可能进 行。 /mol 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 均相反应: A(g)===B(g)+C(g), B =B ⊝ +RTln(PB/P ⊝ ) 反应物化学势随反应进度的增 加而减小,产物的化学势则增 大。系统的G-为一有极小值的 曲线。其斜率rGm 为负,A>0, 正向反应可以自发 进行,一直到底 为零,A=0, 达到化学平衡; 为正,A<0 正向反应不可能进 行。 G mol

§5,1反爱的等温方程 G ● 用 判断,这相当于G-5图上曲线的斜率,因为是微小变 化, 反应进度处于0~1mol之间。 <0 反应自发向右进 a 行,趋向平衡 >0 T.P 反应自发向左进 行,趋向平衡 =0 反应达到平衡 上页 下页 回主目录 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 • 用 判断,这相当于G - 图上曲线的斜率,因为是微小变 化,反应进度处于0~1 mol之间。 T P, G ( ) , 0 T p G 反应自发向右进 行,趋向平衡 ( ) , 0 T p G 反应自发向左进 行,趋向平衡 ( ) , 0 T p G 反应达到平衡
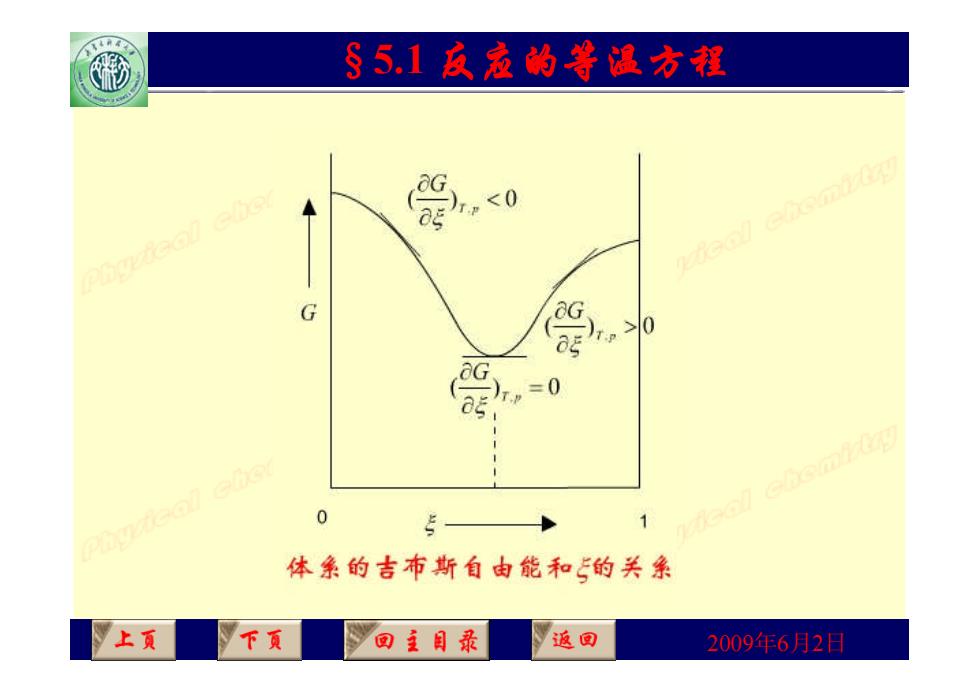
§5.1反丞的等温方翟 0 2次caem2 G 0 5- uiecl elemig 体条的吉布斯自由能和的关系 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程