
9膜滤技术 一教学内容及学时分配(12学时) 9.1概述;9.2微滤和超滤:9.3反渗透和纳滤:9.4电渗析:9.5膜滤技术在水处 理领域中的应用 二教学目的及要求 掌握膜滤技术分类、超滤膜和超滤过滤原理及浓差极化、反渗透膜以及透过 机理、反渗透装置 主要参数工艺流程布置、 电渗析原理及过程、电流效 了极限 电流密度概念、极化与沉淀、电渗析器工艺设计与计算。了解膜滤技术在水处理 领域中的应用。 9.1概述 电渗析、反渗透、纳滤、超滤、微滤以及渗析统称为膜分离法。所谓膜分 离法系指在某种推动力作用下,利用特定膜的透过性能,达到分离水中离子或分 子以及某些微粒的目的。膜分离的推动力可以是膜两侧的压力差、电位差或浓度 差。膜分离具有高效、耗能低、占地面积小等特点,并且可以在室温和无相变的 条件下进行,因而得到了广泛的应用。各种膜去除杂质的范围以及特点如图91 和表91所示 压力驱动膜去除杂质的范围 图9-1 十 0.Imme Irme 10mm 100mm 1um.10uurs 100um 1mmm 截留分子里 100100100000-500000 低分子门高分子门 粒门 分离对缘+ ●OH离 病原性原虫 ●9好 ●开秘究毒”。大肠营 全国离子 反渗通 传统过门 膜适用范屈 的拖和 各种膜分离方法以及特点 表9-1 膜分离种类 推动力 透过物 截物 膜孔径
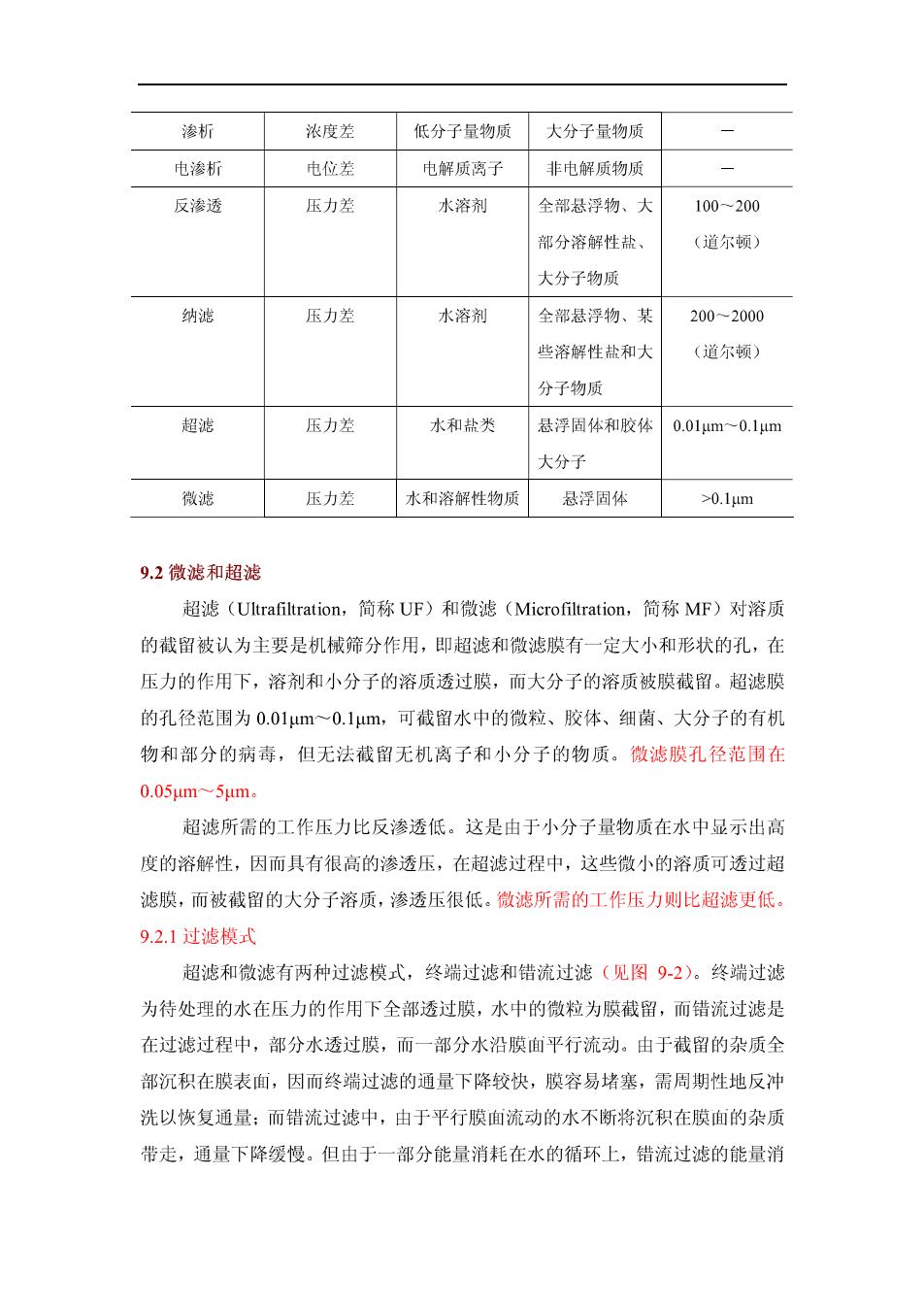
渗析 浓度差 低分子量物质大分子量物质 电渗析 电位差 电解质离子 非电解质物质 反渗透 压力差 水溶剂 全部悬浮物、大 100-200 部分溶解性盐、 (道尔顿) 大分子物质 纳滤 压力差 水溶剂 全部悬浮物、某 200-2000 些溶解性盐和大 (道尔顿) 分子物质 超滤 压力差 水和盐类 悬浮固体和胶认 0.01um~0.1um 大分子 微滤 压力差 水和溶解性物质悬浮固体0.1μm 9.2微滤和超滤 超滤(Ultrafiltration,简称UF)和微滤(Microfiltration,.简称MF)对溶质 的截留被认为主要是机械筛分作用,即超滤和微滤膜有一定大小和形状的孔,在 压力的作用下,溶剂和小分子的溶质透过膜,而大分子的溶质被膜截留。超滤膜 的孔径范围为0.01μm~0.1μm,可截留水中的微粒、胶体、细菌、大分子的有机 物和部分的病毒,但无法截留无机离子和小分子的物质。微滤膜孔径范围在 0.05μm~5μm。 超滤所需的工作压力比反渗透低。这是由于小分子量物质在水中显示出高 度的溶解性,因而具有很高的渗透压,在超滤过程中,这些微小的溶质可透过超 滤膜,而被截留的大分子溶质,渗透压很低。微滤所需的工作压力则比超滤更低 9.2.1过滤模式 超滤和微滤有两种过滤模式,终端过滤和错流过滤(见图92)。终端过滤 为待处理的水在压力的作用下全部透过膜,水中的微粒为膜截留,而错流过滤是 在过滤过程中,部分水透过膜,而一部分水沿膜面平行流动。由于截留的杂质全 部沉积在膜表面,因而终端过滤的通量下降较快,膜容易堵塞,需周期性地反冲 洗以恢复通量:而错流过滤中,由于平行膜面流动的水不断将沉积在膜面的杂质 带走,通量下降缓慢。但由于一部分能量消耗在水的循环上,错流过滤的能量消
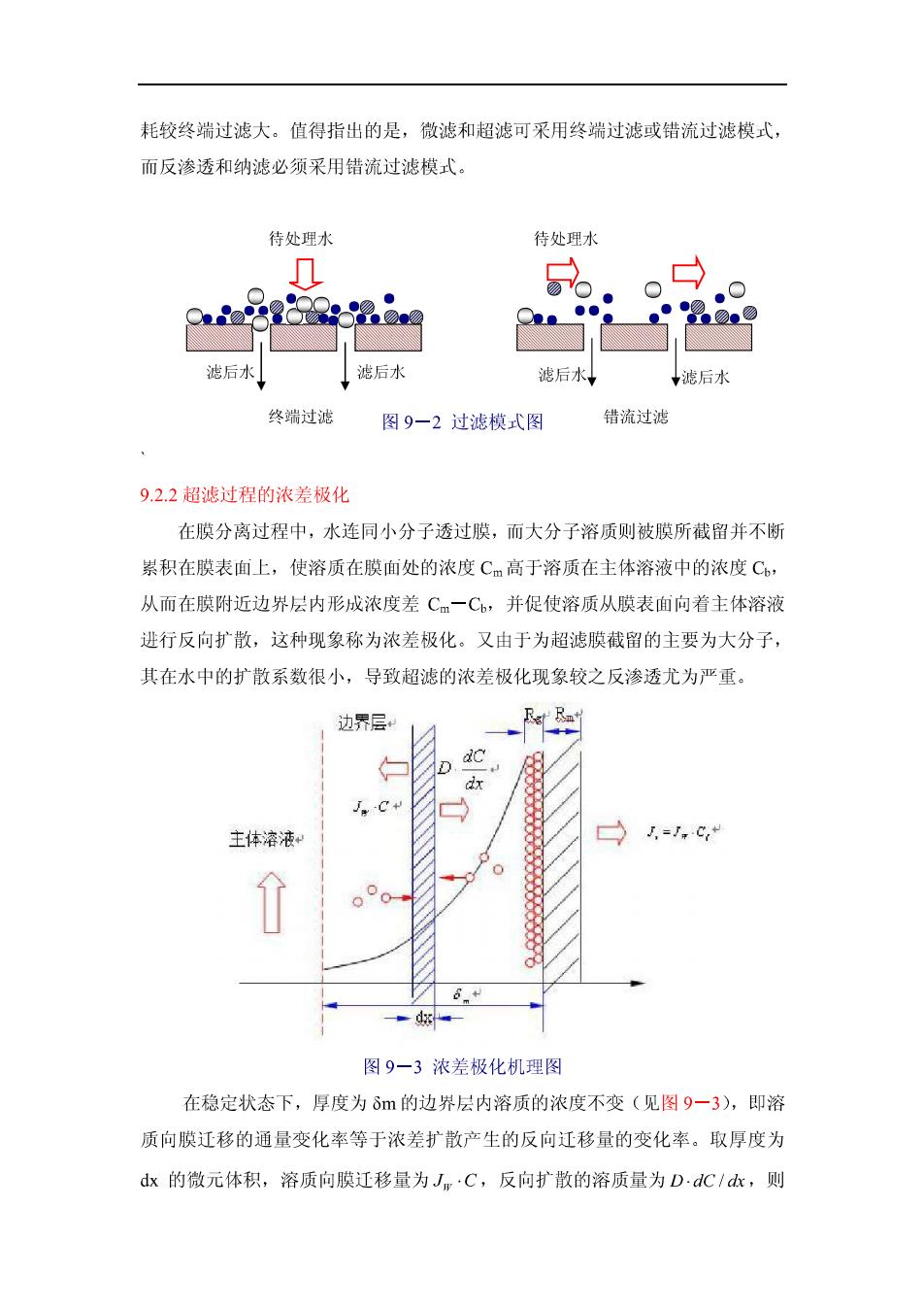
耗较终端过滤大。值得指出的是,微滤和超滤可采用终端过滤或错流过滤模式, 而反渗透和纳滤必须采用错流过滤模式。 待处理水 待处理水 后 滤后水 滤后水 终端过泥 图9一2过滤模式图 错流过滤 9.2.2超滤过程的浓差极化 在膜分离过程中,水连同小分子透过膜,而大分子溶质则被膜所截留并不断 累积在膜表面上,使溶质在膜面处的浓度Cm高于溶质在主体溶液中的浓度C, 从而在膜附近边界层内形成浓度差Cm一C,并促使溶质从膜表面向着主体溶液 进行反向扩散,这种现象称为浓差极化。又由于为超滤膜截留的主要为大分子 其在水中的扩散系数很小,导致超滤的浓差极化现象较之反渗透尤为严重。 边界层 D dc dx 主体溶液 3=.c 图9一3浓差极化机理图 在稳定状态下,厚度为8m的边界层内溶质的浓度不变(见图9-3),即溶 质向膜迁移的通量变化率等于浓差扩散产生的反向迁移量的变化率。取厚度为 dx的微元体积,溶质向膜迁移量为Jm·C,反向扩散的溶质量为D·dC/k,则

有: (9-1 鉴-紧0 (9-2 积分得: 4c-0安G (9-3) 式中D一溶质在水中的扩散系数,cms: C一积分常数。 Jm·C表示迁移向膜的溶质通量,D,dC/本表示由于扩散从膜血返回主体溶液的 溶质通量,在稳定状态下,其差值等于透过膜的溶质通量5。因此,上式可变为: =c-D安 (9.4) 由于J,=mC,上式可变为 JrC,=JC-D.dc Jydks=D.C-C dc 根据边界条件,x=0,C=Cs;x=6n,C=C,积分得: 因C值很小,上式可简化为: kK号 (9-5) 式中的K=D16n,称为传质系数。式(95)表明,在稳态下,Jm与Cn之间保 持对数的函数关系。按公式(9-5),似乎增加Jm可通过增大C的方法来实现, 但增大C必须增加压力。压力的增加提高了透水通量,从而膜表面的溶质浓度 C也随之增加。在浓差极化的情况下,虽然增加压力可提高水通量,但C也随 之增加,浓差极化更加严重。由于溶质在膜表面的崇积,形成了所谓浓差极化层

它增加了膜过滤的阻力。由于是浓差极化造成的,也称为浓差极化阻力。 在大分子溶液超滤过程中,由于Cm值的急剧增加,极化模数Cm/C迅速增 大。在某一压力差下,当C值达到这样的程度,以至大分子物质很快生成凝胶, 此时膜面溶质浓度称为凝胶浓度,以C表示。于是,式(95)相应地改写成 (9-6) 在此情况下,Cg为一同定值,其值大小与该溶质在水中的溶解度有关,因而透 过膜的水通量亦应为定值。若再加大压力,溶质反向扩散通量并不增加。在短时 间内,虽然透过水通量有所提高,但随着凝胶层厚度的增大,所增加的压力很快 为凝胶层阻力所抵消,透过水通量又恢复到原有的水平。因此,一旦生成凝胶层, 透过水通量并不因压力的增加而增加,而与进水溶质浓度C的对数值呈直线关 系减小。凝胶层的形成与处理的对象有很大的关系,这种现象主要发生在化工生 产、废水处理或浓缩的场合,在膜处理给水中,一般不会产生凝胶层现象。 9.3反渗透与纳滤 9.3.1渗透与反渗透 1748年法国学者阿贝·诺伦特(Abbe Nollet)发现,水能自然地扩散到装 有酒精溶液的猪膀胱内,从而发现了渗透现象。动物的膀胱是天然的半透膜。我 们将这些只能透过溶剂而不能透过溶质的膜称为理想的半透膜 用只能让水分子透过,而不允许溶质透过的半透膜将纯水和咸水分开,则 水分子将从纯水一侧通过膜进入咸水一侧,结果使咸水一侧的液面上升,直到某 一高度,此即所谓渗透现象,如图9一4所示。 渗透现象是一种自发过程,但要有半透膜才能表现出来。根据热力学原理 (9-7) 式中μ一在指定的温度、压力下成水中水的化学位: °一在指定的温度、压力下纯水的化学位: x一成水中水的摩尔分数: R一理想气体常数,等于8.314J/moK: T一热力学温度,K。 由于x<1,x为负值,故u,亦即纯水的化学位高于咸水中水的化学位,所