
第1章燃烧中的化学热力学及燃烧化学问题 3 c0(g)+20,(g)0-0,g △h=-282.965kJ/male 表1-1为标准状态下若干物质的生成焓。 2.反应烩与燃烧焓 当反应是在特定的温度、压力下进行时,反应物(R)与产物(P)具有相同的t、P,产物与反 应物间的焓值之差为该反应的反应焓。各反应物及产物的焓值以其生成焓表示。 如果某化学反应的通用表达式为 (1.1) 则该反应的反应焓△Hr为 (1.2) 式中△H的含义:△表示差值,H表示整个反应物或产物的焓而不是单位:质量的焓值以便 与h相区别,下标R、T分别表示为“反应”及反应温度;:为第i种产物的摩尔数,i=1,2,…, p乃为第j种反应物的摩尔数,j=1,2,,i分别表示第j种反应物及第i种产物。 例如 CH(g)+202(g)→C0z(g)+2H0(I) 其反应焓为 △Ha%=-393.505-2×285.85-74.89=-890.3kJ3 显然,如果反应物为元素,产物为其化合物且质量为1mol,则反应焓就是产物的生成焓 用△H一T图可以清楚地表达反应焓与产物的焓值间的关系。如图1-1所示。图中的曲线 R及P分别代表反应物的焙∑n;Ah品及产物的焓n,△hme SH r△h .(T,) a (b) 图1-1△H-T图 ()成热反应(b)吸热反应 当n△hm<∑n,△h,△HRr<0时,为放热反应。反之,当△Hr>)时,为吸热反应。 燃烧焓是反应焓的一种特例,燃烧焓就是单位质量的燃料(不包括氧化剂)作等压燃烧反
燃烧理论基础 应时反应焓之值,可用△表示(下标C表示combustion之意),其单位为k/mol燃料 燃烧的热值或发热量是单位质量的燃料在等压或等容条件下燃烧,燃烧产物的温度与燃 烧温度相等时所释放的热量,在工程上习惯用正值。因此,燃料的热值与其燃烧烙△的数 值相等,但符号相反。在工程界为便于计算而更习惯于用kJ/k(燃料)表达固体燃料及液体燃 料的热值,用k/m(燃料气)表示气体燃料的热值。 表1-1若干物质的标准生成焓(p=0.1MP,T=25℃) 名 称 符 县 状态 生成焓/k·ol1 每化碳 co .110.54 -393.305 烷 CH -74.89 乙炔 C2Hz 226.90 乙烯 52.55 战 气液 正辛 Ca -249.95 正辛烷 s -208.45 -635.13 晶气 -211.27 0 碳(石墨) 0 碳(金刚石) 1.88 水 品气液 2418 -285.85 -84.68 -10385 正昇 丁 -124.7 气气 -131.58 正 -146.4 己烷 -167.92 正庚烷 187.81 丙甲 气气气 20.29 -15.0 -166.36 醇 CHOH -238.57 甲乙 酸酸 C.HO 液 .277.65 液液 409. 革酸(乙酸 -826.76 四氯化碳 8 -139.32 氨基乙酸 -528.56 气气 碘化氢 HI 25.14
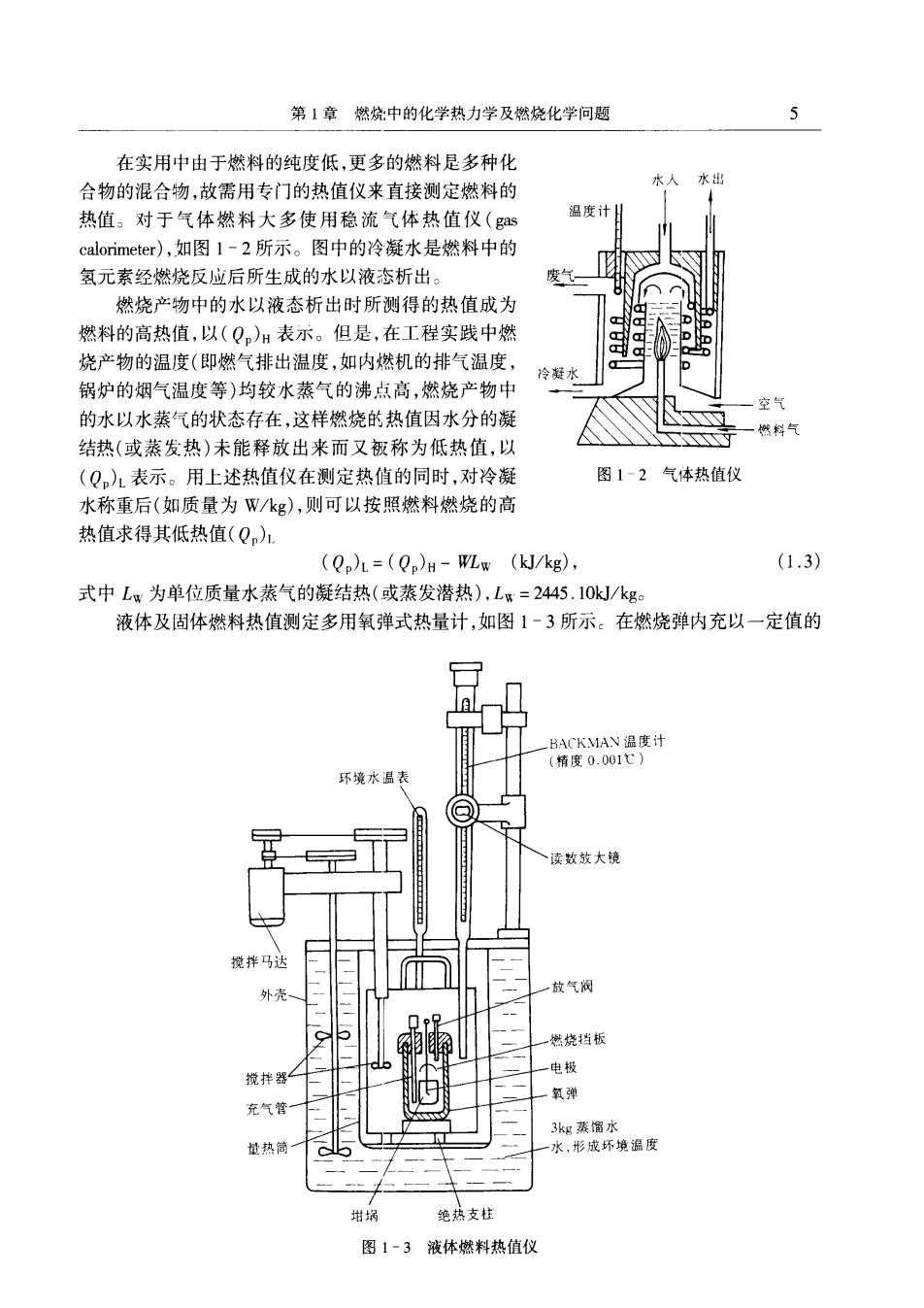
第1章燃烧中的化学热力学及燃烧化学问题 在实用中由于燃料的纯度低,更多的燃料是多种化 合物的混合物,故需用专门的热值仪来直接测定燃料的 水出 热值。对于气体燃料大多使用稳流气体热值仪( 温度计 calorimeter)),如图1-2所示。图中的冷凝水是燃料中的 氢元素经燃烧反应后所生成的水以液态析出。 燃烧产物中的水以液态析出时所测得的热值成为 燃料的高热值,以(Q)H表示。但是,在工程实践中燃 烧产物的温度(即燃气排出温度,如内燃机的排气温度 锅炉的烟气温度等)均较水蒸气的沸点高,燃烧产物中 的水以水蒸气的状态存在,这样燃烧的热值因水分的凝 结热(或蒸发热)未能释放出来而又板称为低热值,以 (Q,)1表示。用上述热值仪在测定热值的同时,对冷凝 图1-2气体热值仪 水称重后(如质量为Wkg),则可以按照燃料燃烧的高 热值求得其低热值(Q)1 (Q)L=(Qp)H-WLw (kJ/kg). (1.3) 式中L为单位质量水蒸气的凝结热(或蒸发潜热),Lx=2445.10k/kg 液体及固体燃料热值测定多用氧弹式热量计,如图1-3所示:在燃烧弹内充以一定值的 环境水温表 读数蚊大镜 放气阀 燃烧板 电极 戏拌器 氧弹 充气管 量热 绝热支柱 图1-3液体燃料热值仪

6 燃烧理论基础 氧气及燃料,燃料放置在氧弹中的坩埚内,氧弹外充以定量的水,整个热值仪的热容量为已知 用电火花引燃。燃料在充满氧气的环境下完全燃烧,从水及热值仪的温升可以计算出燃料燃 烧所发出的热量,从而计算出燃料的热值。由于燃烧物中的水均凝结为液体,故所测得的热值 为定容燃烧的高热值(Q,).同理,可以求得被测燃料的定容低热值为: (Qv)L.=(Qv)-WLw (kJ/kg), (1.4) 由于此试验装置不能直接测得凝结水的质量W,可从燃料成分中H的质量百分比计算求得: F=Muox号(kg,0/kg燃料)。 (1.5) 式中:Mo为氧弹中被测燃料的燃烧反应产生的水的分子量;gH为燃料中H的质量百分比 液体燃料及固体燃料的热值可以按燃料中的组成元素的质量百分数近似地按下式计算 低热值: Q1=4.186x[8100gc+29000(gH-go/8)+2200gs-600gw](kJ/kg), (1.6 高热值: QH=4.186×[8100gc+34400(gH-go/8)+2200gs】(kJ/kg), (1.7) 式中:gC,gH,go,gs,g,分别为燃料中的碳,氢,氧,硫,水的质量百分比。 3.反应焓(及燃烧焓)与反应能(及燃烧能)的比较 从焓的定义可知 h=u+pv, 对于一个反应而论,则有 △HR=△UR+△u=△UR+△nRRT, (1.8) 式中:△UR为反应能;△R为反应后的产物与反应前反应物间分子数的变化;R为通用气体 常数:T为反应温度。 在温度298K时,RT=8.3引4×298=2477.6J/kml=2.48kJ/mol,且因然烧前后的摩尔数 变化不大,以辛烷CgH2为例,然烧反应后△nR=3.5,△nRRT=8.68kJ/mal=76J/kgCsH2,与其 燃烧焓-47837.7J/kg相比,△nRT项其值甚微,在工程上可近似认为 △HR≈△UR, (1.9) 即反应焓(或燃烧焓)与反应能(或燃烧能)近似相等。因而在工程上考虑实测热值Q。及Q, 时常常不加以区别,并将燃烧焓及燃烧能统称燃烧热 4.反应焓(或燃烧焓)与温度的关系 由于燃烧反应多不是在标准状态下进行,如内燃机中开始着火的温度范围为: 汽油机 300℃(573K500℃773K): 柴油机 500℃(773K)-900℃1173K)。 因此在精确计算其热值(或燃烧热)时就必须考虑反应温度的影响,即需要知道反应焓与 温度间的关系。 设燃烧反应为 rR-DP. (1.10) 式中P各为反应物和产物的摩尔数,反应焓与温度的关系可写成 =parT)-7aA(T】=p-,h dT dT -=pCpp-repR

第1章燃烧中的化学热力学及燃烧化学问题 积分后可得 ahu-△Hr-(ep-ed7=p时sd7-dr=paho-7a 可得 △HRr,=△HRr,+(p△hp-rAhR)。 (1.11) 式中:T、T2分别为状态1及2时的温度;△hR,△h,分别为反应物及产物由T1到T2时的显 焓的增值,如图1-1中cd所示。 至此,由生成焓,反应焓及燃烧焙的定义可知,当燃烧反应进行得十分完全时的化学能与 热能的转换关系,化合物及元素的生成焓都含有化学能在内。尽管人们在定义生成焓时有相 对值的概念,而反应焓及燃烧焓却表达了由于化学变化过程所释放或吸收的热能 1.2.2化学平衡与平衡常数一一化学反应过程问题的讨论 作为化学反应的一种情况一—燃烧反应是否能使燃料百分之百地变成理想的最终产物 呢?通过下面的学习来分析这个问题。 1.化学平衡与平衡常数 各种化学反应都同时存在着正反两个方向的反应,即 aA+bB点cC+dD. (1.12) 在特定的温度、压力条件下必然会只有一种平衡状态出现,这时正向反应与逆向反应的速度相 等在反应系统内同时存在着A,B,CD四种化合物。这也就是说,在反应开始时我们只在系 统内放置了适当数量的反应物aA及bB,A与B之间立即按式(1.12)朝右方向反应,产生出产 物C及D。一旦C,D在系统中出现后它们之间就按式(1.12)所示的逆方向(向左)进行反应, 在这样的动态反应过程中,系统中A及B的浓度不断减弱,C及D的浓度不断增加。 反应速度:反应速度(对反应物是消耗速度,对产物是生成速度)的定义为: 反应物A的消耗速度 =d[A] dt 反应物B的消耗速度 ra=d[B] dt 产物C的生成速度 dt 产物D的生成速度 o=d[D] (1.13) 式中[]表示各种物质的浓度。 由于反应是按式(1.12)进行的,各反应物与产物的反应速度应符合该式所表达的计量关 系,即 (1.14) adt bdt r被称为式(1.12)的化学反应速度。显然,反应系统中各化合物的反应速度分别为 ∫rA=-ar,rB=-br, (1.15) (rc=cr,ro=dro 从质量作用原理可知,式(1.12)的瞬时反应速度为: