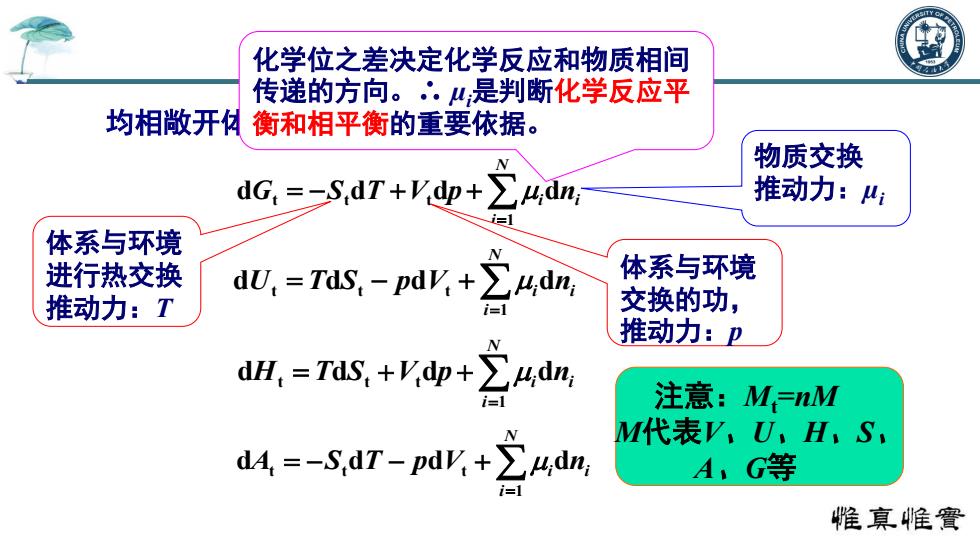
化学位之差决定化学反应和物质相间 传递的方向。∴.是判断化学反应平 均相敞开 】衡和相平衡的重要依据。 物质交换 dG.=二s,dT+yy+∑4dm, 推动力: 体系与环境 进行热交换 dU,=Tis,-p阳K+24n 体系与环境 推动力:T i=1 交换的功, dH,=Tis,+g+之4dn 推动力:卫 注意:M=nM M代表V.U,H,S, dd=-SdT-pdV.+>udn A,G等 惟真帷實
均相敞开体系的热力学基本性质关系式: N i G S T V p i ni 1 d t t d t d d N i U T S p V i ni 1 d t d t d t d N i H T S V p i ni 1 d t d t t d d N i A S T p V i ni 1 d t t d d t d 注意:Mt=nM M代表V、U、H、S、 A、G等 体系与环境 进行热交换 推动力:T 体系与环境 交换的功, 推动力:p 物质交换 推动力:µi 化学位之差决定化学反应和物质相间 传递的方向。∴ µi是判断化学反应平 衡和相平衡的重要依据
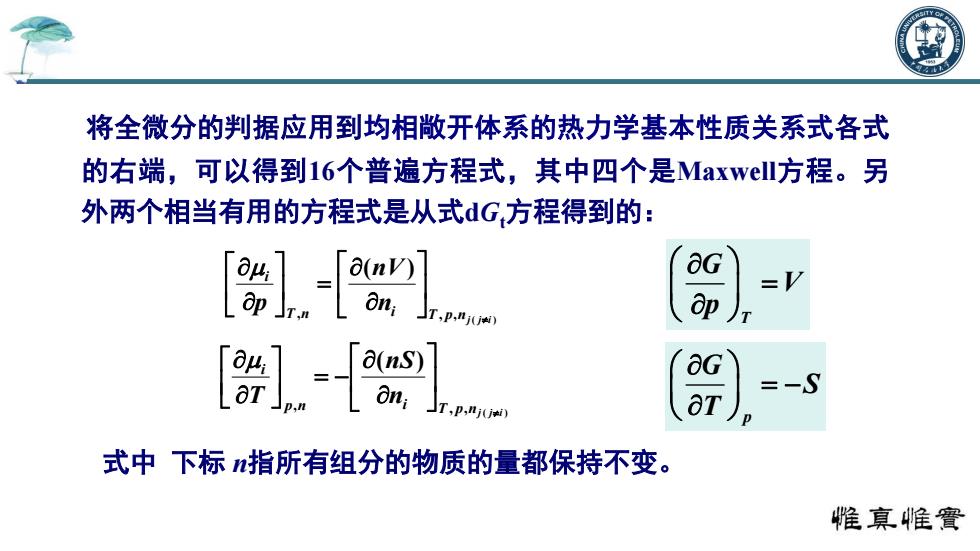
将全微分的判据应用到均相敝开体系的热力学基本性质关系式各式 的右端,可以得到16个普遍方程式,其中四个是Maxwell7方程。另 外两个相当有用的方程式是从式dG方程得到的: aG =V ap =-S T,p,nj(jti) OT) 式中下标指所有组分的物质的量都保持不变。 惟真帷竇
将全微分的判据应用到均相敞开体系的热力学基本性质关系式各式 的右端,可以得到16个普遍方程式,其中四个是Maxwell方程。另 外两个相当有用的方程式是从式dGt方程得到的: 式中 下标 n指所有组分的物质的量都保持不变。 ( ) , , , ( ) T p nj j i T n i i n nV p ( ) , , , ( ) T p nj j i p n i i n nS T T G V p p G S T

第4章 溶液热力学性质的计算 4.1均相敞开系统的热力学基本关系 4.2偏摩尔性质 4.3混合变量 4.4逸度和逸度系数 4.5理想溶液和非理想溶液 4.6活度及活度系数 4.7超额性质 4.8活度系数模型 惟真帷實
4.1 均相敞开系统的热力学基本关系 4.2 偏摩尔性质 4.3 混合变量 4.4 逸度和逸度系数 4.5 理想溶液和非理想溶液 4.6 活度及活度系数 4.7 超额性质 4.8 活度系数模型 第4章 溶液热力学性质的计算

4.2偏摩尔性质 对溶液,热力学性质不仅和温度、压力等有关,而且与体 系的组成有关。 ◆以体系的总体积为例来说明 ~对理想的混合物,其总体积 V >但对一般的真实体系 V 惟真帷竇
对溶液,热力学性质不仅和温度、压力等有关,而且与体 系的组成有关。 以体系的总体积为例来说明 对理想的混合物,其总体积 但对一般的真实体系 4.2 偏摩尔性质 N i V ni Vi 1 t N i V ni Vi 1 t
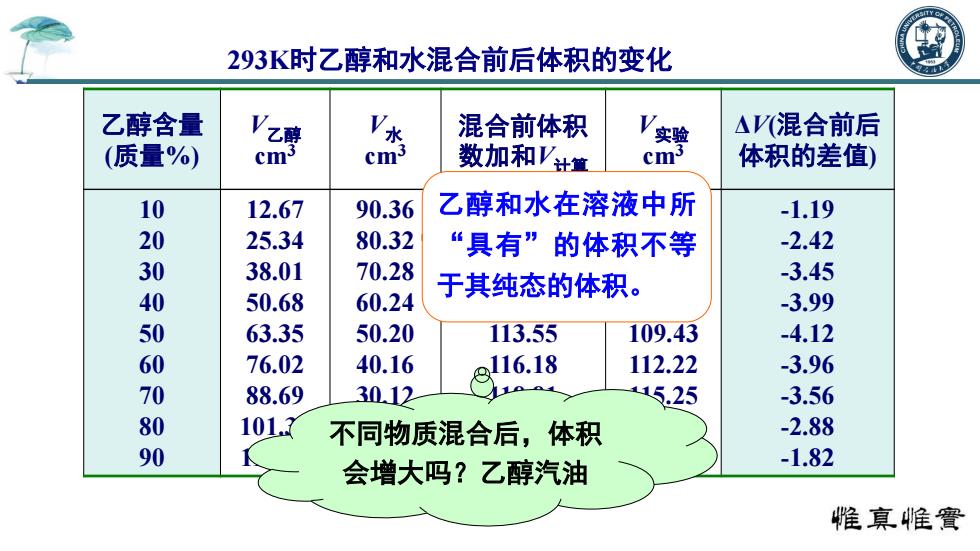
293K时乙醇和水混合前后体积的变化 乙醇含量 Vz 混合前体积 实验 △V(混合前后 (质量%) cm' cm3 数加和Vt童 cm 体积的差值) 10 12.67 90.36 乙醇和水在溶液中所 -1.19 20 25.34 80.32 “具有”的体积不等 -2.42 30 38.01 70.28 60.24 于其纯态的体积。 -3.45 40 50.68 -3.99 50 63.35 50.20 113.55 109.43 -4.12 60 76.02 40.16 116.18 112.22 -3.96 70 88.69 3012 5.25 -3.56 80 101 不同物质混合后,体积 -2.88 90 会增大吗?乙醇汽油 -1.82 惟真帷實
乙醇含量 (质量%) V乙醇 cm3 V水 cm3 混合前体积 数加和V计算 V实验 cm3 ΔV(混合前后 体积的差值) 10 20 30 40 50 60 70 80 90 12.67 25.34 38.01 50.68 63.35 76.02 88.69 101.36 114.03 90.36 80.32 70.28 60.24 50.20 40.16 30.12 20.08 10.04 103.03 105.66 108.29 110.92 113.55 116.18 118.81 121.44 124.07 101.84 103.24 104.84 106.93 109.43 112.22 115.25 118.56 122.25 -1.19 -2.42 -3.45 -3.99 -4.12 -3.96 -3.56 -2.88 -1.82 乙醇和水在溶液中所 “具有”的体积不等 于其纯态的体积。 不同物质混合后,体积 会增大吗?乙醇汽油 293K时乙醇和水混合前后体积的变化