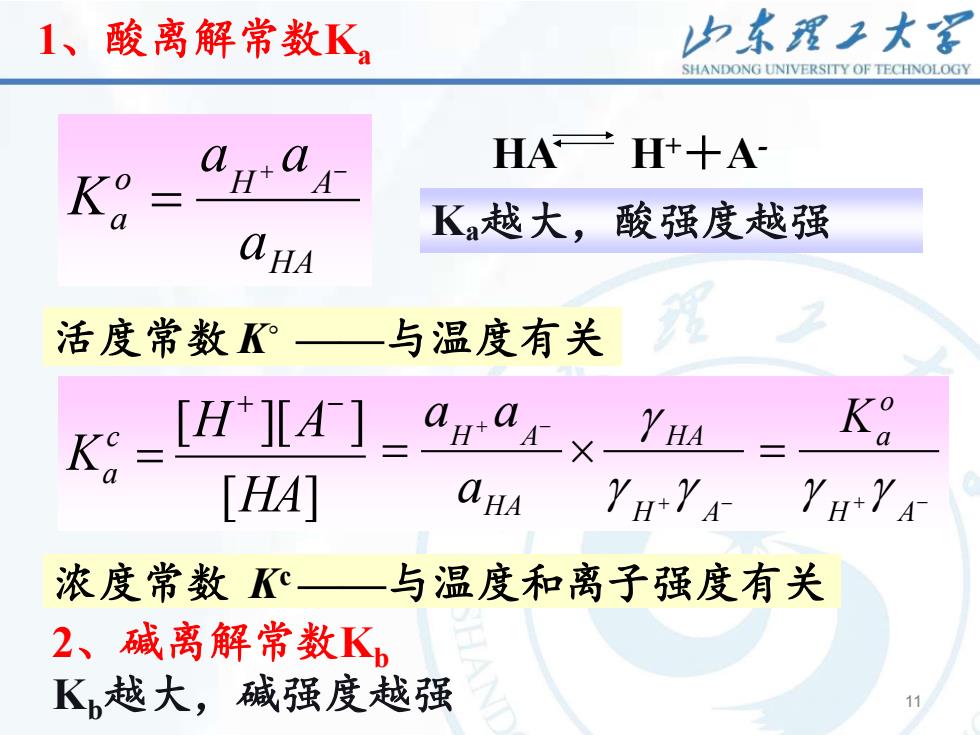
山东理工大客1、酸离解常数KSHANDONGUNIVERSITYOFTECHNOLOGYHA H++AaaHAK°K,越大,酸强度越强qaHA2与温度有关活度常数K°K°aQ[H+A-]2HAHAaKcXaaHA[HA]H+YAH+YA浓度常数Kc.与温度和离子强度有关2、碱离解常数KK,越大,碱强度越强11
11 11 HA o H A a a a a K + − = 1、酸离解常数Ka HA H++A- 活度常数 K◦ ——与温度有关 浓度常数 Kc ——与温度和离子强度有关 [ ] [ ][ ] HA H A K c a + − = + − + − = H A HA HA H A a a a g g g + − = H A o Ka g g Ka越大,酸强度越强 2、碱离解常数Kb Kb越大,碱强度越强

山东理工大客3、共轭酸碱对的酸碱强度关系SHANDONGUNIVERSITY OFTECHNOLOGY[H+[A]KaHAc +H,O<> Ac-+H,O+[HAc][HAc][OH-]Ac-+H,OHAc +OHKh[Ac]pKa +pK, =pKw =14.00[H+][A][HAc][OH']K.·Kb[H+]·[OH'][A][HAc]=KW= 1.0×10-14酸越强,其共轭碱则越弱12
12 12 3、共轭酸碱对的酸碱强度关系 − + HAc + H2 O Ac + H3 O [ ] [ ][ ] C C HA H A Ka + − = − − Ac + H2 O HAc +OH [ ] [ ][ ] − − = Ac HA OH K C b [Ac ] [HAc][OH ] [HAc] [H ][Ac ] K K - - - a b = + [H ] [OH ] - = + = Kw 14 1.0 10− 酸越强,其共轭碱则越弱 = pKa + pKb = pKw =14.00
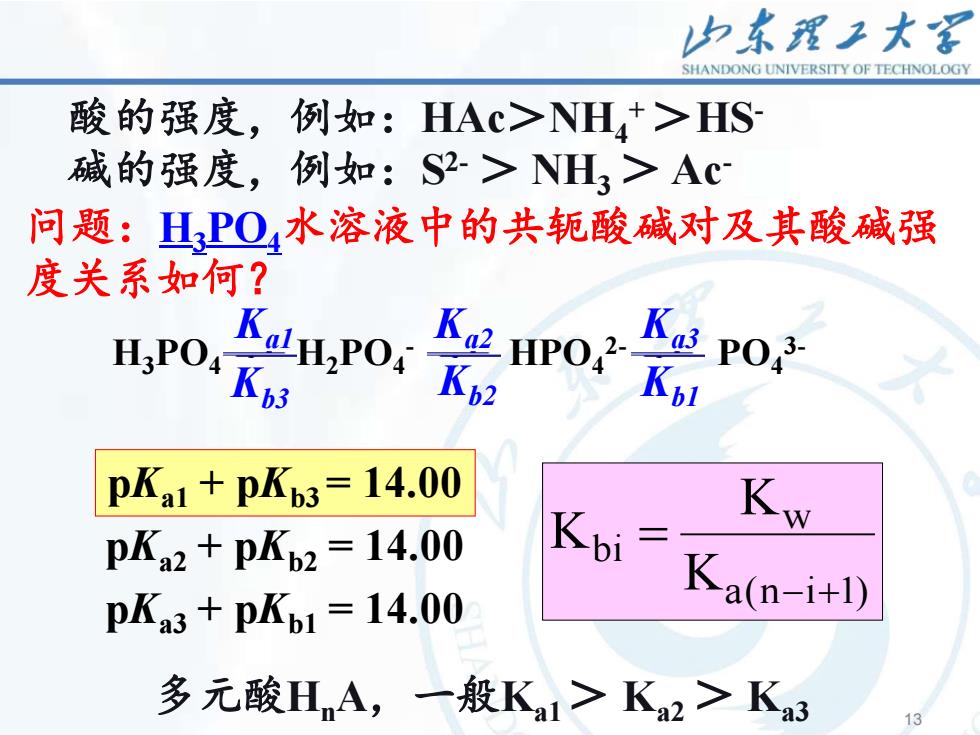
山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY酸的强度,例如:HAc>NH+>HS碱的强度,例如:S2->NH,>Ac问题:H,PQ4水溶液中的共轭酸碱对及其酸碱强度关系如何?KKKala3a2H,PO4.3.2PO4HPO4H,POKp2Kb1Kb3pKa1 + pKb3= 14.00KWKbipKa2 + pKb2 = 14.00Ka(n-i+l)pKa3 + pKb1 = 14.00多元酸H,A,一般Kai>Ka2>Ka313
13 13 酸的强度,例如:HAc>NH4 + >HS- 碱的强度,例如:S 2- > NH3 > Ac- 多元酸HnA,一般Ka1 > Ka2 > Ka3 问题:H3PO4水溶液中的共轭酸碱对及其酸碱强 度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb3 Kb2 Kb1 Ka1 Ka2 Ka3 pKa1 + pKb3 = 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 a(n i 1) w bi K K K − + =
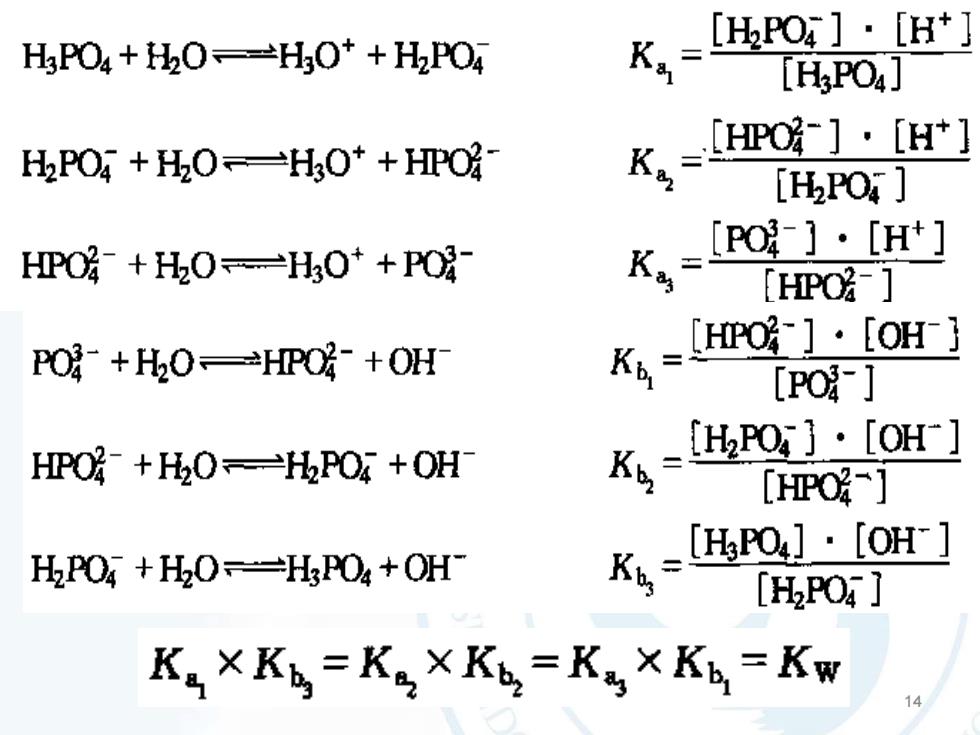
[HPO] - [H+]KaH,PO4 + HO--HsO+ + H2PO4[H,PO4][HPO-]·[H+]K.HPO4 + HO-—H3O+ +HPO[HPO ][PO?-][H+]HPO2- + HO ---H3O+ + POK.[HPO2-][HPO′-]]· [OH-}PO- +HOHPO- +OHKb[PO-][HPO]·[OH"]HPO2- + HO ---HPO4 + OHKb[HPO][HPO4] : [OH-]KbaHPO +HO--H,PO4 +OH[H,PO4 ]K, ×K = K, ×Kb, =Ka × K = Kw
14 14
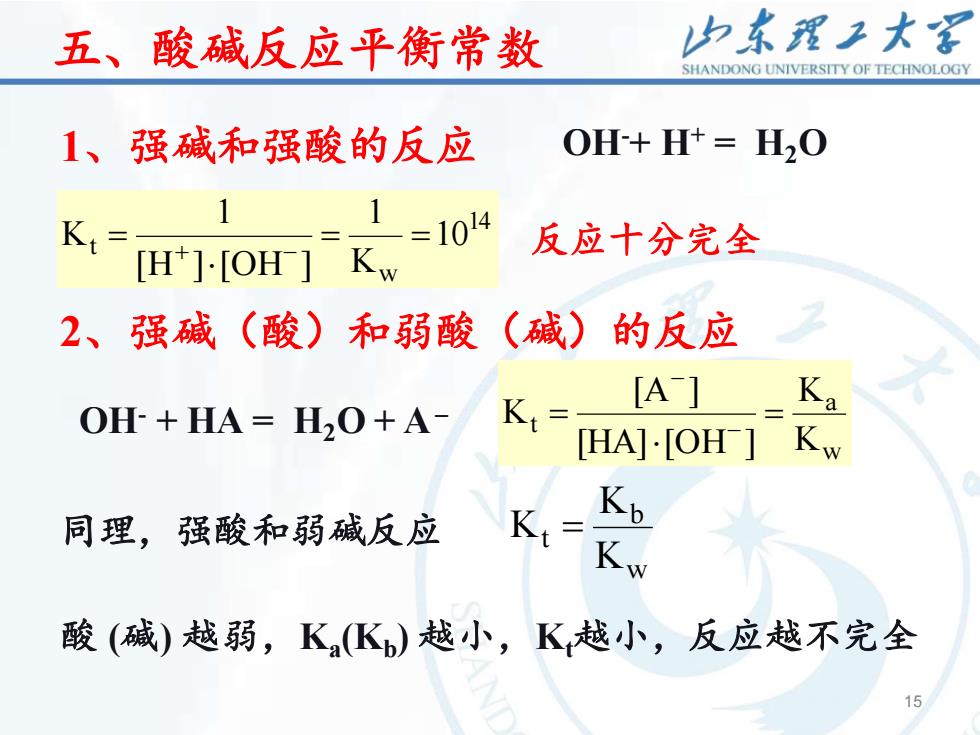
山东理工大客五、酸碱反应平衡常数SHANDONGUNIVERSITYOFTECHNOLOGYOH-+ H+ = H,01、强碱和强酸的反应11=1014Kt=反应十分完全Kw[H+]·[OH](碱)(酸)的反应2、强碱和弱酸Ka[A-]KtOH-+HA=H,O+A-Kw[HA]·[OH-]KbKt=同理,强酸和弱碱反应Kw酸(碱)越弱,K,(K)越小,K越小,反应越不完全15
15 15 五、酸碱反应平衡常数 1、强碱和强酸的反应 OH-+ H+ = H2O 14 w t 10 K 1 [H ] [OH ] 1 K = = = + − 反应十分完全 2、强碱(酸)和弱酸(碱)的反应 w a t K K [HA] [OH ] [A ] K = = − − w b t K K 同理,强酸和弱碱反应 K = 酸 (碱) 越弱,Ka (Kb ) 越小,Kt越小,反应越不完全 OH- + HA = H2O + A–