
(2)与水作用 ● 碱金属被水氧化的反应为: 2Ms)+2H20①)→2M(aq+2OH(aq)+H2(g) 碱土金属被水氧化的反应为: M(s)+2HO①→M(aq+2OH(aq)+H2(g) 远不如相邻碱金属那样剧烈, 镁和铍在水和空气中因生成致密 的氧化物保护膜而显得十分稳定。 上页 返回
(2) 与水作用 ● 碱金属被水氧化的反应为: 2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g) ● 碱土金属被水氧化的反应为: M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g) 远不如相邻碱金属那样剧烈, 镁和铍在水和空气中因生成致密 的氧化物保护膜而显得十分稳定。 Li Na K
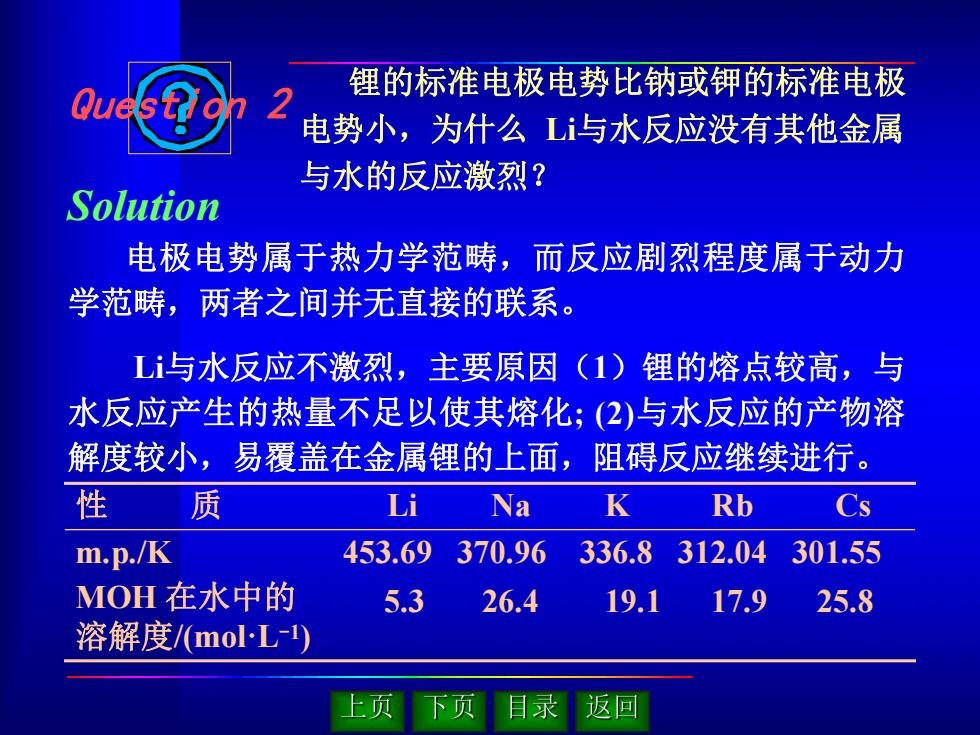
锂的标准电极电势比钠或钾的标准电极 2 电势小,为什么L与水反应没有其他金属 与水的反应激烈? Solution 电极电势属于热力学范畴,而反应剧烈程度属于动力 学范畴,两者之间并无直接的联系。 L与水反应不激烈,主要原因(1)锂的熔点较高,与 水反应产生的热量不足以使其熔化;(2)与水反应的产物溶 解度较小,易覆盖在金属锂的上面,阻碍反应继续进行。 性 质 Li Na K Rb Cs m.p./K 453.69 370.96 336.8312.04 301.55 MOH在水中的 5.3 26.4 19.1 17.9 25.8 溶解度/(molL-1) 上页 下页 目录 返回
锂的标准电极电势比钠或钾的标准电极 电势小,为什么 Li与水反应没有其他金属 与水的反应激烈? 电极电势属于热力学范畴,而反应剧烈程度属于动力 学范畴,两者之间并无直接的联系。 Li与水反应不激烈,主要原因(1)锂的熔点较高,与 水反应产生的热量不足以使其熔化; (2)与水反应的产物溶 解度较小,易覆盖在金属锂的上面,阻碍反应继续进行。 5.3 26.4 19.1 17.9 25.8 性 质 Li Na K Rb Cs m.p./K 453.69 370.96 336.8 312.04 301.55 MOH 在水中的 溶解度/(mol·L-1) Question 2 Solution
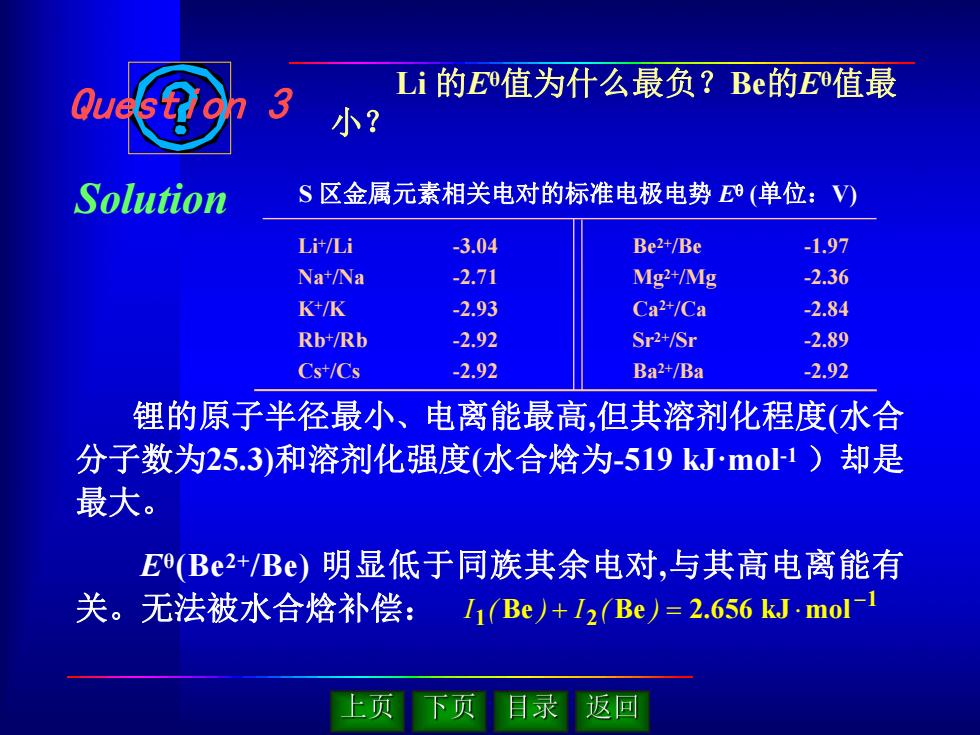
Li的E值为什么最负?Be的E值最 小? Solution S区金属元素相关电对的标准电极电势⑧(单位:V) Li/Li 3.04 Be2+/Be -1.97 Na+/Na -2.71 Mg2+/Mg -2.36 K+/K -2.93 Ca2+/Ca -2.84 Rb+/Rb -2.92 Sr2+/Sr -2.89 Cs+/Cs -2.92 Ba2+/Ba -2.92 锂的原子半径最小、电离能最高,但其溶剂化程度(水合 分子数为25.3)和溶剂化强度(水合焓为-519kJ·mo1)却是 最大。 E(Be2+/Be)明显低于同族其余电对,与其高电离能有 关。无法被水合焓补偿: I1(Be)+1(Be)=2.656 kJ.mol- 上页 返回
Li 的Eθ值为什么最负?Be的Eθ值最 小? S 区金属元素相关电对的标准电极电势 E (单位:V) Li+/Li Na +/Na K+/K Rb+/Rb Cs +/Cs -3.04 -2.71 -2.93 -2.92 -2.92 Be 2+/Be Mg 2+/Mg Ca 2+/Ca Sr 2+/Sr Ba 2+/Ba -1.97 -2.36 -2.84 -2.89 -2.92 Question 3 Solution 锂的原子半径最小、电离能最高,但其溶剂化程度(水合 分子数为25.3)和溶剂化强度(水合焓为-519 kJ·mol -1 )却是 最大。 Eθ(Be 2+/Be) 明显低于同族其余电对,与其高电离能有 关。无法被水合焓补偿: 1 1 Be 2 Be 2.656 kJ mol I ( ) I ( )
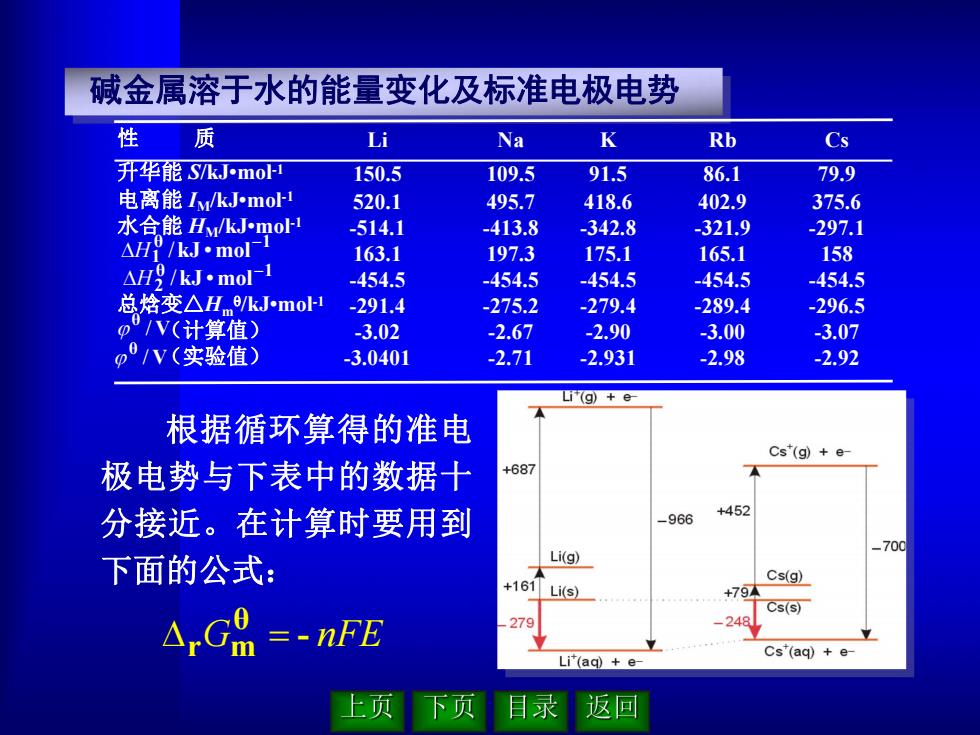
碱金属溶于水的能量变化及标准电极电势 性 质 Li Na K Rb Cs 升华能S/kJ-mol 150.5 109.5 91.5 86.1 79.9 电离能Iy/kJmol1 520.1 495.7 418.6 402.9 375.6 水合能H/kJ小moH -514.1 -413.8 342.8 -321.9 -297.1 H9/kJ.mol厂1 163.1 197.3 175.1 165.1 158 △H吲/kJmol广1 -454.5 -454.5 -454.5 -454.5 -454.5 总焓变△He/kJmo1 -291.4 -275.2 -279.4 -289.4 -296.5 O7V(计算值) 3.02 -2.67 -2.90 -3.00 -3.07 p/V(实验值) -3.0401 -2.71 -2.931 -2.98 -2.92 Li(g)+e 根据循环算得的准电 Cs"(g)+e- 极电势与下表中的数据十 +687 分接近。在计算时要用到 +452 -966 _700 下面的公式: Li(g) +161 Cs(g) Li(s) +79 Cs(s) △,GA=-nFE 279 Cs(aq)e Li(aq)e- 上页 下页 目录 返▣
根据循环算得的准电 极电势与下表中的数据十 分接近。在计算时要用到 下面的公式: G - nFE θ r m 碱金属溶于水的能量变化及标准电极电势 Na 109.5 495.7 -413.8 197.3 -454.5 -275.2 -2.67 -2.71 性 质 升华能 S/kJ•mol -1 电离能 IM/kJ•mol -1 水合能 HM/kJ•mol -1 总焓变△Hm /kJ•mol -1 (计算值) (实验值) Li 150.5 520.1 -514.1 163.1 -454.5 -291.4 -3.02 -3.0401 K 91.5 418.6 -342.8 175.1 -454.5 -279.4 -2.90 -2.931 Rb 86.1 402.9 -321.9 165.1 -454.5 -289.4 -3.00 -2.98 Cs 79.9 375.6 -297.1 158 -454.5 -296.5 -3.07 -2.92 θ 1 1 kJ •mol H / θ 1 2 kJ •mol H / V θ / V θ /

(3) 焰色反应(flame reaction) 碱金属和碱土金属的化合物在无色火焰中燃烧 时,会呈现出一定的颜色,称为焰色反应(fame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外。 元 素 Li Na K Rb Cs Ca Sr Ba 颜 色 深红 黄 紫 红紫 蓝 橙红 深红 绿 波长/nm 670.8 589.2766.5780.0 455.5714.9 687.8553.5 上页 下页 目录 返回
(3) 焰色反应 (flame reaction) 元 素 Li Na K Rb Cs Ca Sr Ba 颜 色 深红 黄 紫 红紫 蓝 橙红 深红 绿 波 长 / nm 670.8 589.2 766.5 780.0 455.5 714.9 687.8 553.5 碱金属和碱土金属的化合物在无色火焰中燃烧 时,会呈现出一定的颜色,称为焰色反应 (flame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外