
基础化学(一) 原子结构与元素周期性 连续光谱:太阳光或白炽灯发出的白 光,通过玻璃三棱镜时,所含不同波 长的光可折射成:红、橙、黄、绿、 青、蓝、紫等没有明显分界线的光 谱,这类光谱称为连续光谱。 特点:波长是连续变化的 (700nmw400nm) 2009-6-2
2009-6-2 7 基础化学(一) 原子结构与元素周期性 连续光谱:太阳光或白炽灯发出的白 光,通过玻璃三棱镜时,所含不同波 长的光可折射成:红、橙、黄、绿、 青、蓝、紫等没有明显分界线的光 谱,这类光谱称为连续光谱。 特点:波长是连续变化的. (700nm~400nm)

基础化学(一) 原子结构与元素周期性 ■2.氢原子光谱 原子(包括氢原子)得到能量(高 温、通电)会发出单色光,经过棱镜 分光得到线状光谱。 ■即原子光谱属于不连续光谱。 每种元素都有自己的特征线状光谱。 氢原子光谱如图5-2所示。 2009-6-2
2009-6-2 8 基础化学(一) 原子结构与元素周期性 2. 氢原子光谱 原子(包括氢原子)得到能量(高 温、通电)会发出单色光,经过棱镜 分光得到线状光谱。 即原子光谱属于不连续光谱。 每种元素都有自己的特征线状光谱。 氢原子光谱如图5-2所示
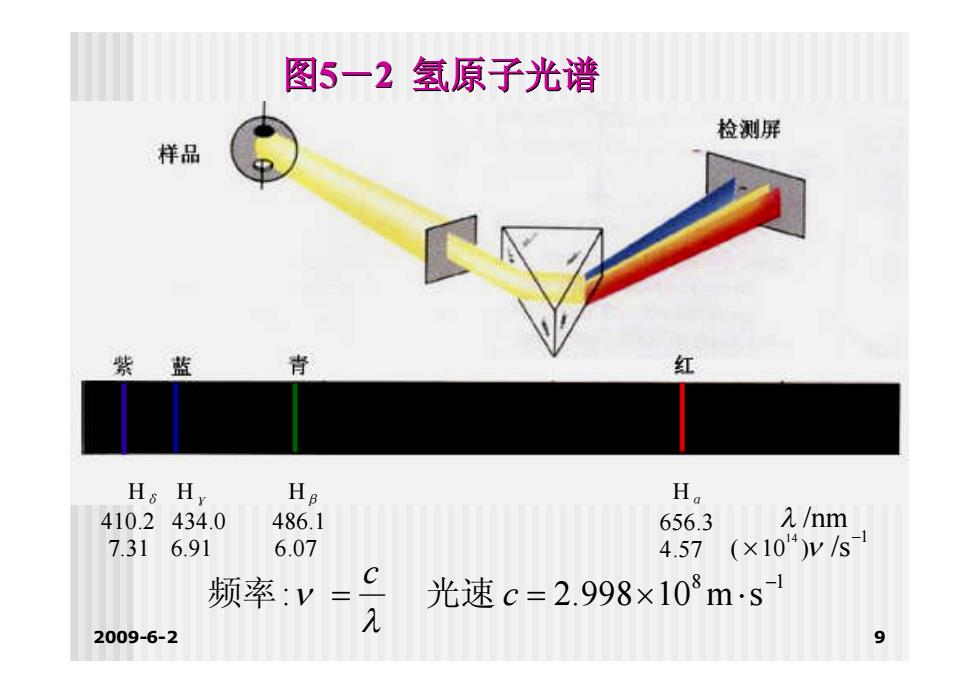
图5一2氢原子光谱 检测屏 样品 紫 蓝 背 红 Hs Hy Ha Ha 410.2434.0 486.1 656.3 /nm 7.31 6.91 6.07 4.57 (×104)ys 频率:y C 光速c=2.998×103ms 2009-6-2 9
2009-6-2 9 图5-2 氢原子光谱 8 1 : 2.998 10 m s c c 频率 光速 /nm Hα 656.3 4.57 Hβ 486.1 6.07 Hγ 434.0 6.91 Hδ 410.2 7.31 1 ( 10 ) /s 14

基础化学(一) 原子结构与元素周期性 氢原子光谱特征: 不连续光谱,即线状光谱 ·其频率具有一定的规律。 经验公式: v-3289×10(分s n=3,4,5,6 2009-6-2 10
2009-6-2 10 基础化学(一) 原子结构与元素周期性 氢原子光谱特征: •不连续光谱,即线状光谱 。 •其频率具有一定的规律。 经验公式: 1 2 2 15 )s 1 2 1 3.289 10 ( n v n= 3,4,5,6

基础化学(一) 原子结构与元素周期性 ■5.1.2波尔理论和原子轨道的能级 ■对氢光谱的解释:波尔理论 ■1.波尔理论 ■1913年丹麦物理学家Bohr发表了原子 结构理论的三点假设: 2009-6-2
2009-6-2 11 基础化学(一) 原子结构与元素周期性 5.1.2 波尔理论和原子轨道的能级 对氢光谱的解释:波尔理论 1.波尔理论 1913 年丹麦物理学家Bohr发表了原子 结构理论 的三点假设: